
题目列表(包括答案和解析)
24.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实
验:
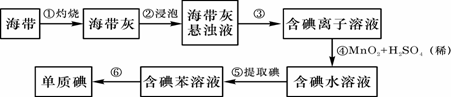
请填写下列空白:
(1)从上述步骤中可知,海带中含有的碘元素的主要存在形式是 。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.干燥器
(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出下列实验
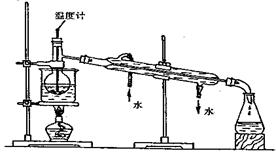 装置中的错误之处。
装置中的错误之处。
①
②
③
进行上述蒸馏操作时,使用水浴的原
因是 ;
(4)步骤④反应的离子方程式是
。
步骤④中的转化还可以Cl2或双氧水
(H2O2),请分别写出反应的离子方程式:
、 。
(5)检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是 。
(6)下列物质,不能作为从碘水中萃取碘的溶剂的是 。
A.热裂汽油 B.CCl4 C.酒精 D.甲苯
(7)步骤③得到的溶液有时候仍是浑浊的,其通常原因是 。
23.(14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻,c和e同主族;a
与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个;常见
化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是 。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和
b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,
Z的晶体类型为 ;ab-离子的电子式为 。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)
。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并
收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 。
22.(6分)根据已有内容的规律进行增补
(1)同族元素单质间的置换反应的化学方程式:
①2Na+2H2O=2NaOH+H2↑ ②2HBr+Cl2=2HCl+Br2
③2H2S+O2=2S+2H2O ④
(2)已知
|
化学键 |
Si-O |
Si-Cl |
H-Cl |
Si-Si |
|
键能/KJ·mol-1 |
460 |
360 |
431 |
176 |
回答下列问题:
①比较熔点SiCl4 SiO2(填“>”或“<” ),
②工业制纯硅反应:1/2SiCl4(g)+H2(g)=1/2Si(s)+2HCl(g)△H=+118KJ·mol-1
则H-H键能为 KJ·mol-1
21.(10分)下图是元素周期表的短周期部分,序号a-h代表8种常见元素。
|
|
IA |
|
O族 |
|||||||
|
第一周期 |
a |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
||
|
第二周期 |
|
|
|
b |
c |
d |
|
|
||
|
第三周期 |
e |
|
f |
|
|
g |
h |
|
||
请用相应的化学用语回答下列问题:
(1)画出g原子结构示意图 。
(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式
。
(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式
。
(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶
液),写出正极的电极反应式: ,负极发生 反
应(填“氧化”或“还原”),OH-移向 极。
20.A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同
主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D
原子最外层电子数的3倍。下列说法中正确的是
A.B、C、D三种元素组成的化合物的化学式为D2CB2
B.A、C两元素处在元素周期表中的第ⅥA族
C.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
D.B、D两元素可形成两种离子化合物,其阴、阳离子数之比均为1∶2
19.下列化学反应中,理论上不能用来设计原电池的是
A.2I- + 2Fe3+ = 2Fe2+ + I2 △H < 0
B.2CO + O2 = 2 CO2 △H < 0
C.BaCl2 + H2SO4 = BaSO4↓+ 2HCl △H < 0
D.Cu + 2FeCl3 = CuCl2 + 2FeCl2 △H < 0
18.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(s)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.②③④ C.①②③ D.④
17.有一种银锌电池.其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为
Zn-2e-+2OH-=ZnO+H2O Ag2O+2e-+H2O=2Ag+2OH-
下列各项中正确的是
A.银锌电池是一种低能电池
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.原电池工作时,负极区溶液PH增大。
D.Zn电极发生氧化反应, Ag2O 电极发生还原反应
16.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和四氯化碳分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
15.取火柴头浸于水中片刻后的溶液,检验溶液中是否含有氯元素的试剂是
A.AgNO3溶液 B.AgNO3溶液和稀HNO3
C.AgNO3溶液、稀HNO3和NaNO2溶液 D.淀粉、KI溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com