
题目列表(包括答案和解析)
23.(7分)A、B、C、D4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称___ _____;B在周期表中的位置第 ______周期,第________族;
(2)A、B形成的化合物的电子式____ ____;
(3)C的元素符号________,C的最高价氧化物的化学式____ ____;
(4) D的最高价氧化物对应的水化物的化学式____ ____.
22. (8分)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+ H2O Zn(OH)2+2Ag;(正反应过程)_________ ____
Zn(OH)2+2Ag;(正反应过程)_________ ____
(2)2C2H2+5O2  4CO2+2H2O; _________ _____
4CO2+2H2O; _________ _____
|
 (3)6H2O+6CO2
C6H12O6+6O2; _____ _________
(3)6H2O+6CO2
C6H12O6+6O2; _____ _________
(4)CaCO3 CaO+CO2↑;_____ _________
CaO+CO2↑;_____ _________
21.在一容积不变的密闭容器中充入2molA和1 molB发生反应:2A(g)+B(g)  xC(g),达到平衡后,C的体积分数为w %;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为w %,则x值为 ( )
xC(g),达到平衡后,C的体积分数为w %;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为w %,则x值为 ( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
第II卷
(把正确答案写在答题纸上)
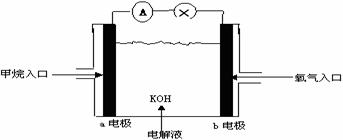
20.下图为甲烷燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应为:4OH- -4e- →2H2O +O2 ↑
C.甲烷燃料电池是一种具有应用前景的绿色电源
D.甲烷燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
19.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn +2OH- →Zn(OH)2 +2e-; Ag2O +H2O +2e- →2Ag +2OH-。下列说法中,正确的是( )
A. 锌发生还原反应,氧化银发生氧化反应 B. 锌是负极,氧化银是正极
C.溶液中OH-向正极移动,K+、H+ 向负极移动
D.在电极放电过程中,电解质溶液的酸碱性基本保持不变
18. 元素A和B的原子序数都小于18,已知A元素的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有 ( )
A、能与水反应 B、能与硫酸反应 C、能与NaOH反应 D、能与碳酸钠反应
17. 向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g) 2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
A.2min时,c(SO2)=0.6mol L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min) -1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数K增大
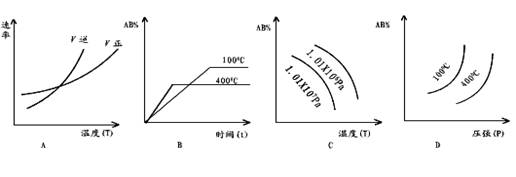
13、对于可逆反应,2AB3(g)  A2(g)
+3B2(g) ΔH > 0,下列图像正确的是( )
A2(g)
+3B2(g) ΔH > 0,下列图像正确的是( )

A.2H2(g)+O2(g)====2H2O(g) ΔH=-Q1 2H2(g)+O2(g)====2H2O(l) ΔH=-Q2
B.S(g)+O2(g)====SO2(g) ΔH=-Q1 S(s)+O2(g)====SO2(g) ΔH=-Q2
C.C(s)+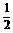 O2(g)====CO(g) ΔH=-Q1 C(s)+O2(g)====CO2(g) ΔH=-Q2
O2(g)====CO(g) ΔH=-Q1 C(s)+O2(g)====CO2(g) ΔH=-Q2
D.H2(g)+Cl2(g)====2HCl(g) ΔH=-Q1 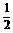 H2(g)+
H2(g)+ 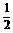 Cl2(g)====HCl(g) ΔH=-Q2
Cl2(g)====HCl(g) ΔH=-Q2
12.发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
11.镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。电池的总反应式是:1/2 H2+NiO(OH)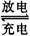 Ni(OH)2。根据此反应式判断,下列叙述中正确的是
( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是
( )
A.电池放电时,电池负极周围溶液的pH不断增大 B.电池放电时,镍元素被氧化 C.电池充电时,氢元素被还原 D.电池放电时,氢气是负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com