
题目列表(包括答案和解析)
5.能够发生银镜反应且与丙酸互为同分异构体的是( )
A. 甲酸乙酯 B. 丙醛 C. 乙酸甲酯 D. 乙酸铵
4.下列有机物的命名正确的是( )
A. 3,3-二甲基-4-乙基戊烷 B. 3,3,4-三甲基-1-己烯
C. 3,4,4-三甲基己烷 D. 2,3,3-三甲基-2-庚烯
3.下列有机物的1H-NMR图谱上只给出一组峰的是( )
A.HCHO B.CH3OH C.HCOOH D.CH3COOCH3
2. 下列有机物在适量的浓度时,不能用于杀菌、消毒的是( )
A.苯酚溶液 B.乙醇溶液 C.乙酸溶液 D.乙酸乙酯溶液
1.下列物质属于天然高分子化合物的是( )
A.聚乙烯 B.尼龙 C.油脂 D.纤维素
23.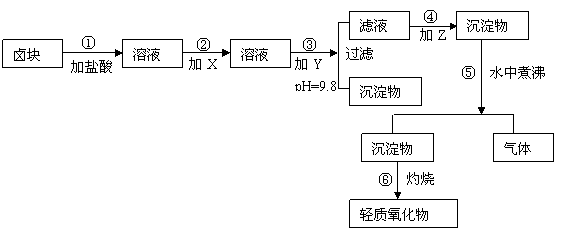 (6分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
(6分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
轻质氧化镁工艺流程图
表1 化学试剂价格表 表2 生成氢氧化物沉淀的值
|
试剂 |
价格(元/ t ) |
|
漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。请填写以下空白:
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。
22.(12分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;

请完成下列填空:
(1)H的电子式 ;检验H 中阳离子的方法是 。
(2)A与B 在加热条件下反应的主要现象是 ;F晶体中所含化学键为 ;
F和H2O的化学方程式 ;1mol的F与足量的水反应转移电子物质的量为 。
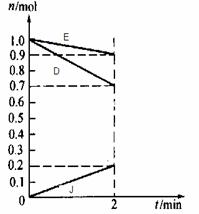 (3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用J表示的平均反应速率为____________。
(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用J表示的平均反应速率为____________。
21.(12分)某课外活动小组设计如下图所示装置,进行氯气的制备及有关性质实验。
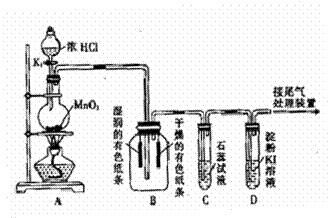 (1)装置A中发生反应的离子方程式
(1)装置A中发生反应的离子方程式
为 。
(2)上述装置中明显存在不足之处,
为保证装置B中实验成功,应在装置
A、B之间添加一个装置,该装置
是 (填“I”、“Ⅱ”或“Ⅲ”)

(3)装置C中溶液发生的颜色变化为
请在方框内填写出颜色变化及导致该阶段颜色变化的粒子符号。
|
阶段 |
1 |
2 |
3 |
|
颜色变化 |
|
|
|
|
粒子符号 |
|
|
|
(4)装置D中起始的实验现象是 。
(5)实验结束后,对装置A的烧瓶中残存的气体的处理方法是 。
20. (6分)A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸。网
(6分)A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸。网
|
|
|
(1)A中反应的离子方程式为 ,
B中Cu极电极反应式为 。
(2)C中被腐蚀的金属是 ,总反应方程式为 ,
A.B、C中铁被腐蚀的速率,由大到小的顺序是 。
19.(10分)Ⅰ下表为元素周期表前三周期的一部分。
|
|
|
||
|
X |
|
Z |
|
|
W |
Y |
|
R |
(1)X的氢化物的沸点与W的氢化物的沸点比较: > ___ (填化学式),原因是 。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式 _ ,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合 。(填序号)。
|
|
C.泡利不相容原理 D.洪特规则
(3)以上五种元素中, 元素原子失去核外第一个电子需要的能量最多(填元素符号)。
II.(1).一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式: ,
(2).乙烯分子中有 个σ键, π键,以 杂化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com