
题目列表(包括答案和解析)
2.将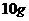 氢气和
氢气和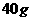 氧气混合点燃,放出
氧气混合点燃,放出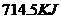 热量,同样条件下
热量,同样条件下 氢气在氧气中
氢气在氧气中
完全燃烧放出的热量是
A.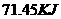 B.
B.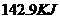 C.
C.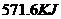 D.
D.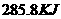
1.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段
时间后,析出钾、镁、铝的物质的量之比为
A.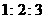 B.
B.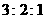 C.
C.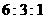 D.
D.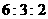
28、 (7分)依据氧化还原反应:2Ag+(aq)+Cu (s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
(7分)依据氧化还原反应:2Ag+(aq)+Cu (s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。

(1)Cu AgNO3 (2) 正 Ag++e-= Ag Cu-2e-= Cu2+(3)负 正 或铜 银

27、(共5分)在密闭容器中通入a mol H2和b mol I2(g),改变下列条件,反应速率将如何改变?(1)升高温度 ______ ;(2)加入正催化剂 _______ ;(3)体积不变充入更多的H2 ________;
(4)扩大容器的体积 _______;(5)容器体积不变,通入氖气 ________;
(1)加快 (2)加快 (3) 加快 (4) 减慢 (5)不变
26、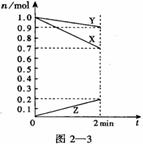 (5分)某温度时,在2 L容器中,X、Y、Z三种物质的物质的
(5分)某温度时,在2 L容器中,X、Y、Z三种物质的物质的
量随时间变化曲线图2-3所示。由图中数据分析,该反应的
化学方程式为:________________________________________。
反应开始至2 min,Z的平均反应速率为 __________。
(2)(6分)取a mol A和b mol B置于V L容器中,发生可逆反应:
aA(g)+bB(g) 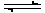 cC(g)+dD(g),1 min后,
cC(g)+dD(g),1 min后,
测得容器内A的浓度为x mol·L-1,这时B的浓度为: ;
C的浓度为:
。在这段时间内反应速率若以物质A的浓度变化来表示,应为__________。(1)3X
+ Y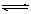 2Z;0.05 mol/L·min
2Z;0.05 mol/L·min
(2)bx/a mol/L, (c/v-vx/a) mol/L (a-vx)/v mol/L·min
25、(5分)t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(恒容),发生如下反应:
3A(g)+ B(g )  xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入适量氦气(假设氦气和A、B、C都不反应)后,原化学平衡(填字母)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断
(4)若向原平衡混合物的容器中再充入2amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足
24、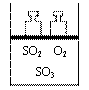 (4分)如右图所示将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
(4分)如右图所示将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)  2SO3(g)
ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
2SO3(g)
ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数
(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:
或 。
(2)若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 。
(1)减小 升温、减压
(2)任意值 (或c≥0)
(3)3.6<c≤4
23、(2分)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂
反应的△H(填“增大”“减小”或“不改变”)。 向左 不改变
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂
反应的△H(填“增大”“减小”或“不改变”)。 向左 不改变
22. (6分)下表中的数据表示破坏1 mol物质中的化学键需消耗的能量(即键
能):
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
键能/kJ·mol-1 |
436 |
243 |
431 |
H2和Cl2反应生成HCl过程中的热效应可用下图表示,回答下列问题:
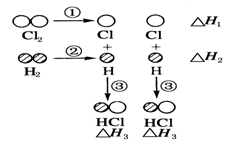
(1)ΔH1=__________,ΔH2=_________,ΔH3=_______。
(2)据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,你认
为引发该反应的第一步是上图①-③中分子转化为原子的哪一步
(填序号)步,请说明原因:___________________________________
(3)该反应的热化学方程式为:__________
(1)+243 kJ·mol-1 +436 kJ·mol-1 -431 kJ·mol-1
(2)① Cl-Cl键的键能比H-H键的键能小,更易断裂,从而引发反应
(3)H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
21、分别回答下列问题。(10分)
(1)从H+、Na+、Cu2+、Cl-、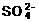 中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
①电解过程中溶液颜色变浅且水量不变_______________________;
②电解过程中电解质含量不变,水量减少_______________________;
③电解过程中,两极析出气体的体积比为1∶1__________。
(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体
在标准状况下的体积约为 ;
②用铂电极电解0.02 mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为
(忽略溶液体积的变化) ;
③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ
 C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热
3847kJ,则混合气体中氢气与丙烷的体积比是 。
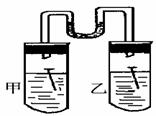
(3)如右图所示,甲、乙两试管中各放一枚铁钉,甲试管中
为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是 ,甲中正极反应为
,负极反应式为,乙中正极反应为 ,负极反应式为 。
(1) ①CuCl2 ②H2SO4或 Na2SO4 ③HCl 或 NaCl
(2)①0.28L ②0.04mol/L ③3:1
(3)U形管左端液面上升,右边液面下降 O2 + 2H2O + 4e- == 4OH- 2H+ +2e-=H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com