
题目列表(包括答案和解析)
32. (6分)在一个固定容积的密闭容器中,保持一定温度进行以下反应:
H2(g) + Br2(g) ⇌ 2HBr(g)
已知加入2 mol H2和1molBr2,达到平衡时生成a mol HBr(见表已知项)。在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写表中的空白:
|
|
起始状态物质的量(mol) |
平衡时HBr物质的量(mol) |
||
|
H2
|
Br2 |
HBr |
||
|
|
2 |
1 |
0 |
a |
|
⑴ |
4 |
2 |
0 |
|
|
⑵ |
|
|
1 |
0.5 a |
|
⑶ |
m(m≥2n) |
n |
|
|
31.(6分)在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
30.(12分)有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒
压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1
的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下
使之发生如下反应:2SO2+O2 2SO3。试填写下列空格:
2SO3。试填写下列空格:
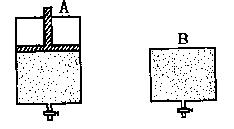
(1)A容器达到平衡时所需的时间比B容器_________;平衡时A容器中SO2的转化率比B容器_______;
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学平衡__________________移动,B容器中化学平衡_______________移动;
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
29. (8分)某反应A+B C在任一时刻的正、逆反应速率都可用υ正、υ逆表示:υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度.
C在任一时刻的正、逆反应速率都可用υ正、υ逆表示:υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度.
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为 .
(2)在300K时,开始反应的A、B浓度均为0.1mol·L-1,达平衡时B的转化率为50%,则 k1、k2之间的关系是 .
(3)升高温度,k1、k2的变化是 ,k1/k2增大,说明正反应是 (填“吸”或“放”)热反应.
28.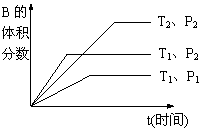 (4分)已知某可逆反应mA(g)+nB(g)
(4分)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。如图所示
qC(g)在密闭容器中进行。如图所示
反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
(⑴、⑵、⑶题填“>”、“<”或“=”):
⑴温度的关系:T1________T2;
⑵压强的关系:P1________P2;
⑶化学计量数的关系:m+n______q;
⑷该反应的正反应为___________反应。(填“吸热”或“放热”)
27.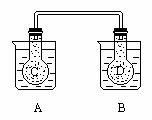 (2分)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有
500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向
A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和
D 中气体的颜色变化是______
(2分)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有
500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向
A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和
D 中气体的颜色变化是______
① 不变 ② 烧瓶 C 中颜色变深,D 中变浅
③ 烧瓶 D 中变深, C 中变浅 ④ 两个烧瓶中的颜色都变深
26.(4分)K2Cr2O7是橙红色晶体,K2Cr2O4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,可以发生的离子反应方程式为:Cr2O2-7+H2O 2CrO2-4+2H+,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
2CrO2-4+2H+,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
(1)向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,则试管中的溶液呈 色.原因是 .
(2)向(1)所得的溶液中滴入5滴2mol·L-1的硫酸,试管中溶液呈 色,理由是 .
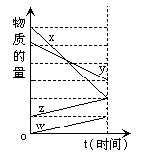
24.(2分)下图表示在某温度下经时间t反应后,物质 X、Y、Z、W 的物质的量的大致变化情况。则所发生反应的化学方程式是__________________________________
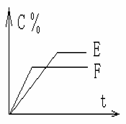 25. (6分) mA(气) + nB(气)
25. (6分) mA(气) + nB(气) 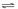 pC(气) + qD(气) 的 C % 与时间 t 有如图关系
pC(气) + qD(气) 的 C % 与时间 t 有如图关系
(1)若E、F表示两种温度,则 E____F ( 填 > 、< 或 = ),正反应____ 热
(2)若E、F表示两种压强,则 m + n_____p + q
23. (6分)把 3mol A 和 2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:
3A(气) + B(气) 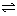 xC(气) + 2D(气)
xC(气) + 2D(气)

22.化学反应速率υ和反应物浓度的关系是由实验方法制定的.化学反应H2+Cl2=2HCl的反应速率υ=K[c(H2)]m·[c(Cl2)]n,式中的K为常数,m、n值可用下表中的数据确定出:
|
c(H2)mol·L-1 |
c(Cl2)(mol·L-1) |
v(molL-1·S-1) |
|
1.0 |
1.0 |
1.0k |
|
2.0 |
1.0 |
2.0k |
|
2.0 |
4.0 |
4.0k |
由此可推得m、n值正确的是( )
A.m=1,n=1 B.m=0.5,n=0.5 C.m=0.5,n=1 D.m=1,n=0.5
桃源一中高二化学《化学平衡》测试题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com