
题目列表(包括答案和解析)
23.(6分)(1)已知浓度均为0.1 mol/L的8种溶液:①CH3COONa、②KCl、③NH4Cl 、④NaOH 、⑤Ba(OH)2、⑥HNO3、⑦H2SO4、⑧CH3COOH,其溶液的pH由小到大的顺序是______________ (填写序号)。
(2)25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答:
若a+b=12,则Va: Vb= 。
若Va<Vb和a=0.5b,则a的取值范围是_________________。
22.(13分)完成下列反应的化学方程式(有机物写结构简式),是离子反应的只写出离子方程式。
⑴实验室用新制的消石灰和氯化铵反应制取氨气
______________________________________________________________。
⑵碳酸氢钠溶液与硫酸铝溶液混合反应
______________________________________________________________。
⑶新制的氢氧化亚铁悬浊液露置在空气中
______________________________________________________________。
⑷实验室制取乙烯
。
⑸丙烯在一定条件下生成聚丙烯
______________________________________________________________。
(6)配平下列氧化还原反应方程式:
FeSO4 + HIO3 + = Fe2(SO4)3 + I2 + H2O
21.(12分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步还原氧化铜和制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。
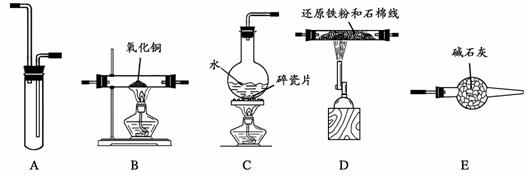
(1)实验时,按气体从左到右的流向,装置的连接顺序是(填大字母编号):C接
______________________接B。
(2)装置A的作用是 。C中碎瓷片的作用是 。E的作用是 。
(3)B中的现象是_____________________________________ __。
(4)为了安全,在B管中的反应发生前,在气体的最后出口处必须
;B管中的反应开始后,在气体的最后出口处应
。
(5)待反应完成、D管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。取滤液制取FeCl3·6H2O晶体,设计流程如下:
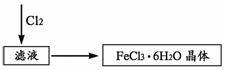
从滤液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________________。
20.(10分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了测定其纯度,用浓度为0.1152mol/L的盐酸标准溶液进行滴定。试回答下列问题:
(1)托盘天平称量3.2 g固体试剂,再用蒸馏水在烧杯中充分溶解并冷却至室温后,用玻璃棒引流转入500 mL容量瓶中,恰好至刻度线,振荡、摇匀即配成待测液备用。请指出以上操作中出现的错误有(多写倒扣分)
。
(2)将标准盐酸装在50.00 mL (填“酸式”或“碱式”)滴定管中,调节液面位置使其在 处,并记下刻度。
(3)取25.00 mL待测液并加入指示剂待测定。该项实验操作需要的主要仪器有
。
(4) 下列实验操作中,会引起测定结果偏低的(填字母) 。
A.转移待测液至容量瓶时,末洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
(5) 某同学所得实验数据如下表所示,据此,请写出上述固体试剂中NaOH的质量分数的计算式(不要化简) 。
|
实验编号 |
盐酸的浓度/ mol·L-1 |
滴定完成时,盐 酸滴入的体积/mL |
待测NaOH溶液 的体积/mL |
|
1 |
0.1152 |
26.72 |
25.00 |
|
2 |
0.1152 |
28.02 |
25.00 |
|
3 |
0.1152 |
26.70 |
25.00 |
19.(4分)下列实验操作或对实验事实的叙述正确的是_____________(填序号)。
①为了测定一包白色粉末的质量,用托盘天平称量时将药品放在左盘,砝码放在右盘,并移动游码使之平衡即可
②实验室制氨气时,选用无水CaCl2做干燥剂
③仅用蒸馏水和pH试纸作试剂,就可以鉴别pH相等的H2SO4溶液和CH3COOH溶液
④进行镁跟二氧化碳反应的实验时,将点燃的镁条放入盛有二氧化碳的集气瓶(瓶底部要放一些细沙)里即可
⑤为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
⑥用水或硝酸银溶液都可以将溴蒸气和二氧化氮气体区别开来
2.答卷前将密封线内的项目填写清楚。
18. 将60 mL甲烷和乙烷的混合气体与210 mL氧气混合,点火燃烧,将反应后的混合物通过浓硫酸充分吸收后,得剩余气体130 mL(气体体积均在同温同压下测定),则下列叙述中正确的是
A.所得130 mL剩余气体中是CO、CO2的混合物
B.所得130 mL剩余气体的平均相对分子质量是30
C.60 mL混合气体含甲烷为20 mL
D.根据题给条件无法求出60 mL混合气体中甲烷或乙烷的体积
徐州市2005--2006学年度年第一学期期末考试
高二化学试题(必修加选修)
第二卷 (非选择题 共76分)
l.用钢笔或圆珠笔(除题目有特殊规定外)直接答在试卷上。
17.T °C时气体A与气体B在某容器中反应生成气体C和固体D,每1 mol A与足量B完全反应时生成1 mol D,反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。
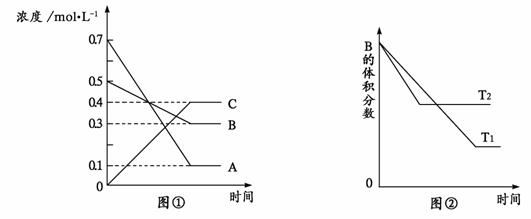
则下列结论正确的是
A.该反应的化学方程式是 A+3B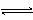 2C+D
2C+D
B.T°C时,保持容器体积不变,若向上述平衡体系中加入0.2 mol C,则重新达平衡时B的浓度小于0.3 mol/L
C.其它条件不变,升高温度时,正、逆反应速率均增大,且A的转化率减小
D.相同时间内,消耗0.3 mol/L A时,生成了0.1 mol/L B,则反应达到平衡
16.下列各图象中,横坐标为向某溶液中加(通)入某反应物的物质的量,纵坐标为沉淀物的量,则下列叙述中错误的是
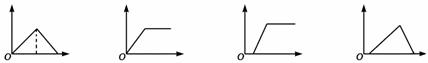
A B C D
A. 向氯化铝溶液中加入过量的氨水,其图像是B
B. 向饱和石灰水中通入过量的CO2气体,其图像是A
C. 向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量,其图像是D
D. 向含少量NaOH的偏铝酸钠溶液中通入过量的CO2气体,或向其中逐滴加入稀盐酸,其图像都是C
15.某金属元素M的常见化合价有+4和+6,其与氮、氧元素组成的化合物MO2(NO3)2受热可发生的分解反应为:
MO2(NO3)2-- MXOY + NO2↑+ O2↑
在600 K 时,将气体产物收集于试管中并倒扣于水中,气体全部被吸收、水充满试管。则生成的M的氧化物的化学式是
A.MO3 B.MO2 C.MO2·2MO3 D.2MO2·MO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com