
题目列表(包括答案和解析)
2、在日光的照射下,下列物质不发生化学变化的是
A、浓HNO3
B、H2和N2的混合气 C、溴化银 D、氯水
3、在一密闭烧瓶中,在25℃时存在着平衡:2NO2 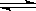 N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
4、实验室存放下列药品的方法错误的是
A、少量白磷贮存在水中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、液溴贮存在水中 D、浓硝酸贮存在棕色的细口玻璃瓶中
5、在一定条件下,反应A2(g)+B2(g)
N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
4、实验室存放下列药品的方法错误的是
A、少量白磷贮存在水中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、液溴贮存在水中 D、浓硝酸贮存在棕色的细口玻璃瓶中
5、在一定条件下,反应A2(g)+B2(g) 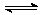 2AB(g)达到平衡状态的标志是
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
6、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A 2:1:2 B 5:5:4 C 1:1:1 D无法确定
7、有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107- 5×107Pa,因在该压强下铁触媒的活性最大
8、对已达化学平衡的下列反应:2X(g)+Y(g)
2AB(g)达到平衡状态的标志是
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
6、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A 2:1:2 B 5:5:4 C 1:1:1 D无法确定
7、有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107- 5×107Pa,因在该压强下铁触媒的活性最大
8、对已达化学平衡的下列反应:2X(g)+Y(g) 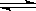 2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
9、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g)
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
9、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g) 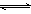 CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
10、在密闭容器中进行如下反应:N2+3H2
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
10、在密闭容器中进行如下反应:N2+3H2 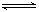 2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
(1)平衡不发生移动 (2)平衡沿着正反应方向移动(3)平衡沿着逆反应方向移动
2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
(1)平衡不发生移动 (2)平衡沿着正反应方向移动(3)平衡沿着逆反应方向移动
(4)NH3的质量分数增加(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
11、含有硫酸铵和硝酸铵的混合溶液AL,加入amolNaOH,刚好使氨气全部逸出,加入bmolBaCl2,刚好使SO42-离子全部沉淀,则混合溶液中硝酸铵的物质的量浓度是
A、a/Amol/L
B、A/bmol/L
C、(a-2b)/A
mol/L D、(a-b)/A mol/L
12、某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
二、选择题(每小题有1-2个正确答案)
13、下图表示的平衡混和物中,产物X的百分含量在不同压力下随温度改变的情况,在下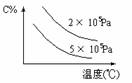 述哪一个可逆体系中X可代表用横线标明的物质
A N2(g)+O2(g)
述哪一个可逆体系中X可代表用横线标明的物质
A N2(g)+O2(g) 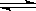 2NO(g)(正反应吸热)
B 2SO3(g)
2NO(g)(正反应吸热)
B 2SO3(g) 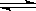 2SO2(g)+O2(g)(正反应吸热)
C N2(g)+3H2(g)
2SO2(g)+O2(g)(正反应吸热)
C N2(g)+3H2(g) 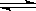 2NH3(g)(正反应放热)
D 4NH3(g)+3O2(g)
2NH3(g)(正反应放热)
D 4NH3(g)+3O2(g) 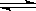 2N2(g)+6H2O(g)(正反应放热)
14、 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
15、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g)
2N2(g)+6H2O(g)(正反应放热)
14、 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
15、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g) 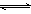 2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
16、已知碱能除去硝酸尾气:NO+NO2+2NaOH
2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
16、已知碱能除去硝酸尾气:NO+NO2+2NaOH
2NaNO2+H2O。根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的
A.1molO2和4molNO2
B.1molNO和4molNO2
C.1molO2和4molNO
D.4molNO和1molNO2
17、氢叠氮酸HN3与氢卤酸相似,它是易挥发的弱酸,下列叙述中不正确的是
A 它的水溶液中存在着N3-离子 B 是无色、有刺激性气味的气体
C NaN3与稀硫酸作用生成HN3 D 它与氨作用生成的是共价化合物
18、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO42-
B.MnO4-、K+、Cl-、H+、SO42-
C.Na+、Ba2+、NO3-、HCO3-、SO42- D.K+、NO3-、SO42-、OH-、Na+
1、本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是 A.化学反应速率理论是研究怎样在一定时间内快出产品 B.化学平衡理论是研究怎样使用有限原料多出产品 C.化学反应速率理论是研究怎样提高原料转化率 D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
31、⑴ 2.99 g ⑵ 14
30、(1)100mL溶量瓶(注:未标明规格的扣1分)
(2)>b(多选扣分)
(3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质。
29、⑴ 900 ⑵ 1000 ⑶ 100
28、⑴1 ⑵ 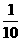 ⑶10a + b – 14;>
⑶10a + b – 14;>
27、⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。
(2)C>A>B
(3)C
26、小于;250C时纯水的pH = 7,当升高温度时,水的电离程度增大,c(H+)也增大,故
pH减小
扣2分,多选、错选均不给分)
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
CD |
CD |
B |
A |
AD |
AD |
D |
CD |
D |
D |
|
21 |
22 |
23 |
24 |
25 |
|
|
|
|
|
|
D |
B |
BC |
C |
D |
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
A |
B |
C |
B |
B |
D |
B |
B |
B |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com