
题目列表(包括答案和解析)
8.在一定温度和压强下,将装有氮气和二氧化氮混合气体的试管倒立于水中,经足够时间后,试管内气管内气体积缩小为原体积的 ,则原混合气体中氮气和二氧化氮气体的体积比是
( )
,则原混合气体中氮气和二氧化氮气体的体积比是
( )
A. 2:3 B. 3:2 C. 3:5 D.5:3
7. 下列各组气态氢化物中,按稳定性由弱到强的顺序排列正确的是 ( )
A. AsH3、PH3、H2S、HCl B. HF、HCl、HBr、HI
C. NH3、H20、HF、H2S D. H2O、NH3、CH4、H2S
6.下列各组离子,在强酸性溶液中能大量共存的是 ( )
A. K+、Na+、F-、NO-3
B. Na+ Fe2+、Cl-、N03-
C. N0-3、Cl-、Na+、K+
D. SO23-、NO3-、Na+、K+
5. 鉴别二氧化氮和溴蒸气应选用的试剂是 ( )
A. NaOH溶液 B. AgNO3溶液.
C. 淀粉碘化钾溶液 D. 石蕊试液
4. 可逆反应A(g)+3B(g)  2C(g)+2D(g),在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中反应速率最快的是 ( )
A. vA=0.5mol/ (L·s) B. vB =0.6mol/ ( L·s)
C. vc=0.4mol/ ( L·s) D. vD=0.45mol/ (L·s)
3.下列反应达平衡后,缩小体积,增大压强或升高温度,平衡都向同一方向移动的是( )
A.2NO2 N2O4(正反应为放热反应)
N2O4(正反应为放热反应)
B.NH4HCO3(s) NH3+H2O(g)+CO2(正反应为吸热反应)
NH3+H2O(g)+CO2(正反应为吸热反应)
C.3O2 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
D.H2S H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
2.能充分说明可逆反应N2(g)+O2(g) 2NO(g)已达到平衡状态的是 ( )A.O2的消耗速率等于NO的消耗速率
2NO(g)已达到平衡状态的是 ( )A.O2的消耗速率等于NO的消耗速率
B.容器中存在N2、O2、NO三种气体
C.容器混合物总的物质的量不随时间而改变
D.单位时间内每生成n mol N2的同时生成2n mol NO
1.下列气体能用碱石灰干燥的是 ( )
A.Cl2 B.NH3 C.HC1 D.CO2
30.(12分) 化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
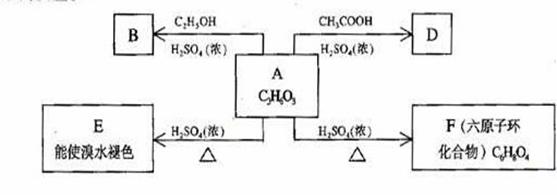
试写出:
化合物的结构简式:A___________________ B_________________
D___________________
化学方程式:A→E_____________________________________
A→F____________________________________
反应类型:A→ E______________,A→F_______________
29.(12分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
② 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_______________________________________________________________________________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系_________________________________________________________________________________________。
③ 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_________________________________________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com