
题目列表(包括答案和解析)
27. 除去NO中混有的NO2,采用的方法是________________________
26. 实验室制取氨气,所用装置与制________气的装置相同,反应的化学方程式为____________。如氨已充满容器,这时将蘸有浓盐酸的玻璃棒接近容器口,可观察到___________现象。
25. 将固体NH4I置于密闭容器中,在某温度下发生下列反应: NH4I(s)?NH3(g)+HI(g), 2HI(g) ?H2(g) +I2(g)
当达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则NH3的浓度为 ( )
A.3.5mol·L-1 B.4mol·L-1 C.4.5mol·L-1 D.5mol·L-1
24.在一密闭恒容的容器内进行下列反应4NH3(g)+502(g) 4NO(g)+6H2O(g),在一定条件下建立平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ( )
4NO(g)+6H2O(g),在一定条件下建立平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是 ( )
A. 容器内压强增大 B. 原平衡不受影响
C. 正反应速率减小 D. NO的浓度降低
23.在一定温度下,反应H2(g)+I2(g) 2HI(g)在密闭容器中进行,当下列情况不随时间变化时,能说明反应已达到平衡的是 ( )
2HI(g)在密闭容器中进行,当下列情况不随时间变化时,能说明反应已达到平衡的是 ( )
A. 容器内的压强 B. 混合气体的平均相对分子质量
C. 各组分的百分含量 D. 混合气体的颜色
22. 将1mol So2和1mol O2通入恒容密闭容器中,在一定条件下反应达到平衡,平衡时,SO3达到0.3 mol。此时若移走0.5 mol O2和0.5 mol SO2,则反应达到新的平衡时,SO3的物质的量是 ( )
A. 0.3 mol B.0.15 mol
C. 小于0.15 mol D.大于0.15 mol,小于0.3 mol
21. 某温度下1L密闭容器中,加入1mol N2和3mol H2,使反应N2(g)+3H2(g) 2NH3(g)达平衡,测得平衡时,NH3的浓度为Cmol/L,若维持s容器体积不变,温度不度,以下配比作为起始物质,达到平衡时NH3的浓度仍为Cmol/L的是
( )
2NH3(g)达平衡,测得平衡时,NH3的浓度为Cmol/L,若维持s容器体积不变,温度不度,以下配比作为起始物质,达到平衡时NH3的浓度仍为Cmol/L的是
( )
A. 2mol NH3
B.2mol N2+6mol H2
C. 0.5mol N2+1.5 molH2+1mol NH3
D.1mol N2+3mol H2+1mol NH3
20. 某单质和浓硝酸反应时,每有 0.25mol单质反应消耗1mol HNO3,还原产物为NO2,则单质氧化后的化合价可能是( )
A. +1 B. +2 C. +3 D. +4
19. E(s)+3F(g) 2G(g)(正反应为吸热反应),如图表示外界条件(温度、压强)
2G(g)(正反应为吸热反应),如图表示外界条件(温度、压强)
的变化对下列反应的影响。在图中Y轴是指 ( )
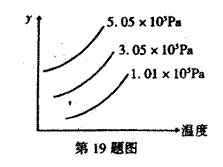 A. F的转化率
A. F的转化率
B. E的物质的量
C. 平衡混合物中G的百分含量
D.平衡混合物中F的百分含量
18. 一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示该反应的平均速率为 ( )
A.0.2mol·L-1·min-1 B.0.6mol·L-1·min-1
C.0.1mol·L-1·min-1 D.0.3mol·L-1·min-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com