
题目列表(包括答案和解析)
19.(9分)
(1)C、E 每个1分,计2分;错选1个扣1分,扣完2分为止
(2)防止暴沸 2分
(3)防止乙醇、乙酸挥发 2分
(4)C 1分
(5)冷凝、防止倒吸 各1分
26. (10分)乙烯和乙烷的混合气体共amol, 与bmol的氧气共存于一密闭容器中, 点燃后充分反应, 乙烯和乙烷全部消耗完, 得到CO和CO2的混合气体和45g的水, 求:
(1)当a=1时, 乙烯和乙烷的物质的量之比为多少?
(2)当a=1时, 且反应后CO和CO2的混合气体的物质的量为反应前氧气的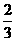 时, 求b的值和此时生成CO和CO2的物质的量的比值.
时, 求b的值和此时生成CO和CO2的物质的量的比值.
(3)a的取值范围是多少?
扬州市2003-2004学年度第二学期期末调研测试试题
高二化学答案及评分标准
第Ⅰ卷(选择题 共72分)
25.(8分)某饱和一元羧酸和饱和一元醇所生成的酯1.76g与30mL 1mol/L的NaOH溶液在加热下反应,待反应完全后,测得生成饱和一元醇0.92g,反应后的混合物中剩余的NaOH需用40mL 0.25mol/L盐酸才能刚好中和。求这种酯的结构简式及名称。
24.(11分)有机物参加的反应往往比较复杂,常有副反应发生;如下图中乙烯跟溴水反应既可生成A.同时又可生成B和C2H5Br。
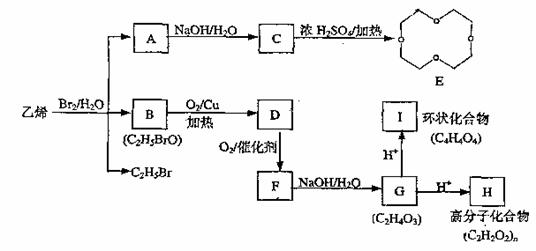
回答下列问题:
(1)环氧乙烷(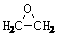 )的结构可简写为
)的结构可简写为 则E的分子式是 。
则E的分子式是 。
(2)B的结构简式是 ;I的结构简式是 。
(3)写出G转化为H的化学方程式:
(4)化合物A-I中,易发生加成反应的物质是 (填字母)。
23.(9分)酯和醇反应生成新的酯和新的醇的反应称为酯交换反应:
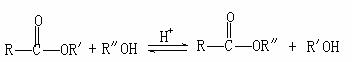
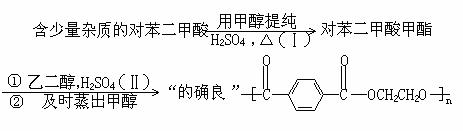
工业上生产的“的确良”是以甲醇、乙二醇和对苯二甲酸(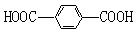 )为原料生产的。具体合成途径如下:
)为原料生产的。具体合成途径如下:
完成下列填空:
(1)反应(Ⅰ)的化学方程式为 。
(2)反应(Ⅱ)的类型是 (填加聚或缩聚)。
(3)反应(Ⅱ)中为何要及时蒸出甲醇? 。
(4)合成时,若消耗的乙二醇的物质的量比对苯二甲酸多千分之五,上述聚合物中的链节数n= 。
22.(10分)已知CH3CH2CH2NO2性质稳定,它既不与NaOH反应,又不与盐酸反应。下图是某有机物的球棍模型,请根据模型写出此有机物的分子式 ,它的结构简式是 。
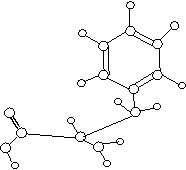
它的同分异构体有多种,其中A和B分子中均含有苯环,且苯环上只有两个邻位取代基,取代基所含的原子数相差1个。
(1)A既能与强酸反应,又能与强碱反应,则A的结构简式为 (任写其中一种);
(2)B既不溶于强酸,又不溶于强碱,则B的结构简式为 (任写其中一种)。
(3)若C是B的同分异构体,它可以看作是芳香烃经一硝化后的唯一产物(硝基连在苯环上)。则C的结构简式为 。
21.(10分)几年来,有些不法商贩因在食品中填加了“吊白块”以达到漂白增色、防腐、增加米面制品的韧性及口感的目的受到了国家质检总局的严肃查处。“吊白块”化学名称为甲醛次硫酸氢钠,是由甲醛和次硫酸氢钠(可表示成Na+[OSOH-])反应制得:

回答下列问题:
(1)“吊白块” (填“易”、“难”)溶于水。
(2)甲醛能使 变性凝固,所以可用其浓溶液保存动物标本和尸体。
(3)甲醛是非常重要的合成原料。纯净的甲醛在催化剂的作用下,生成聚甲醛-- 一种优良的工程塑料,聚甲醛的结构简式为 ;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,则此己糖的分子式为 。
(4)已知:C + H2O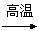 某混合气体M ,
某混合气体M , 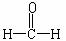 +某混合气体M
+某混合气体M 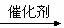 A
A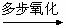 B 其中A可还原新制的Cu(OH)2悬浊液亦可与乙酸发生酯化反应;B的相对分子质量是
B 其中A可还原新制的Cu(OH)2悬浊液亦可与乙酸发生酯化反应;B的相对分子质量是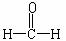 的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。则:
的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。则:
①A的同分异构体有(填结构简式) 、 。
②A催化加氢的化学方程式 。
③B可被酸性KMnO4 溶液氧化,在方框中填上B的结构简式并配平离子方程式。






+ MnO4- + H+ - CO2↑+ Mn2+ + H2O
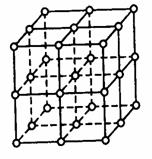
20.(11分)氯化钠晶体易溶于水,不溶于苯或四氯化碳。右图中直线交点处的圆圈为氯化钠晶体中Na+ 离子或Cl-离子所处的位置。
(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体的结构示意图。
 (2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有
个。
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有
个。
(3)晶体中每一个重复的结构单元叫晶胞。在氯化钠晶胞中正六面体的顶点上、面上、棱上的Na+离子或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于 , Na+离子的个数等于 。
(4)利用X射线可测得氯化钠晶体中靠得最近的Na+离子与Cl-离子之间的距离为d,借助这一数据,某化学实验小组设计了一个测定阿伏加德罗常数的方案,该方案的关键是要测定氯化钠晶体的密度。
①若实验室现有天平、酸式滴定管(25mL)、容量瓶(25mL)等仪器,请你设计一个测定氯化钠晶体密度的实验方案(氯化钠晶体已研细,其它试剂自选)。
②经测定氯化钠晶体的密度为ρ摩尔质量为M,试写出计算阿伏加德罗常数的公式(式中物理量都用字母表示) 。
19.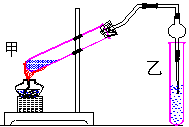 (9分)右图是某学生设计的制取乙酸乙酯的实验装置图,该学生并进行了以下主要实验操作:①在甲试管中加入适量乙醇,浓硫酸和冰醋酸;②小心均匀加热3min~5min。
(9分)右图是某学生设计的制取乙酸乙酯的实验装置图,该学生并进行了以下主要实验操作:①在甲试管中加入适量乙醇,浓硫酸和冰醋酸;②小心均匀加热3min~5min。
(1)该学生所设计的图及所进行的实验操作中,错误的是__________(填下列选项的标号)
A.乙试管中的导管插入溶液中 B.乙试管中盛饱和Na2CO3溶液
C.先加浓硫酸后加乙醇、冰醋酸 D.甲试管中导管太短
E.乙试管中盛饱和碳酸氢钠溶液
(2)甲试管中可放入干燥的碎瓷片,其作用是 。
(3)需小心均匀加热的原因是________________________________________。
(4)从反应后的混合物中提取乙酸乙酯,宜采用的简便方法是__________(填下列选项的标号)
A.蒸馏 B.渗析 C.分液 D.过滤 E.结晶
(5)在装置中,球形干燥管主要起到两个作用:a ,b _____ ___ _____。
第II卷(非选择题 共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com