
题目列表(包括答案和解析)
2.下列化合物中,可以通过相应的单质直接化合而成的是( )
A. H2SO4 B. FeCl2 C.Al2S3 D.CuS
1.下列各组物质不属于同素异形体的是( )
A.35Cl和37Cl B. O2和O3 C.金刚石和C60 D.白磷和红磷
25.将8molSO2和4molO2充入密闭容器内,在一定温度进行反应,起始时容器内的压强为3×105Pa,达平衡时容器内的压强为2.2×105Pa。求SO2的转化率。
24.下图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。请选择适宜装置的序号填于空白处。
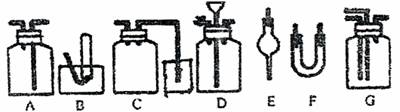
(1)既能用于收集Cl2,又能用于收集NO的装置是 ;
(2)能用作干燥CO2气流的装置是 ;
(3)在实验室制取Cl2并检验Cl2性质的连续实验中,用于除去Cl2中的HCl杂质的最佳装置是 ;
(4)合成氨实验中,可用于干燥、混合并能大致观察H2和N2的体积比的装置是 ;
(5)用于尾气吸收并能防止液体倒吸到反应装置中的是 ;
(6)接在气体的连续实验中间,用于达到控制气流使其平稳目的的装置是 。
23.537℃、1.01×105Pa时,往容积可变的密闭容器中充入2molSO2、1molO2;此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
 2SO2(气)+O2(气) 2SO3(气)达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
2SO2(气)+O2(气) 2SO3(气)达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2molSO3并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L。
(2)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、bmolO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a= 。
22.已知25℃时0.1mol·L-1醋酸溶液的pH约为3。向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大。你认为上述两种解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1的醋酸溶液中加入少量下列物质 (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确,溶液PH应 (填增大或减小或不变)已知25℃时0.1mol·L-1氨水和0.1mol·L-1醋酸的电离程度相同)
21.将盛有48毫升一氧化氮,二氧化氮的混合气体的容器倒置于水中,(保持同温同压)液面稳定后,容器内气体体积变为24毫升气体,则
(1)原混合气体中一氧化氮是 毫升,二氧化氮是 毫升。
(2)若在剩余24毫升气体中通入24毫升氧气,液面稳定后,容器的气体体积是 毫升。
(3)若在原48毫升一氧化氮,二氧化氮气体中,通入 毫升氧气再倒置于水中,气体会全部吸收。
20.在一固定容积的密闭容器中,充入2molA和1molB发生反应:2A(气)+B(气)=xC(气)达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA,0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x的值 ( )
A.1 B.2 C.3 D.4
第Ⅱ卷
19.0.3molCu2S与足量的浓硝酸反应,生成硝酸铜、硫酸、二氧化氮和水,则参加反应的硝酸,被还原的硝酸的物质的量为 ( )
A.0.6mol B.1.2mol C.2.2mol D.3.0mol
18.已知HF的酸性比HCN的酸性强。现有物质的量浓度和体积均相同的NaF和NaCN两种溶液。已知前者溶液中的离子数目为n1,后者溶液中的离子数目为n2,下列关系正确的是 ( )
A.n1=n2 B.n1>n2 C.n1<n2 D.c(F-)>c(CN-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com