
题目列表(包括答案和解析)
31.(理科)(共7分)下列物质(均为中学化学常见物质)转化关系图中,已知:B、C为单质,H为红褐色沉淀 (反应条件及部分反应物、产物未全部注明)。
请根据图示转化关系填写下列空白:
(1) 写出D的化学式:
(2) 写出由A→I的离子方程式
(3)写出由K→J的离子方程式
(4)写出由G→H的化学反应方程式
31.(文科)(共7分)某混合物A,含有KAl(SO4)2、Al2O3,在一定条件下可实现如
下图所示的物质之间的变化:
据此判断:
(1)固体C的化学式为 ;
(2) 反应①的离子方程式为 ;
(3)欲用实验证明固体E中有NH4+存在,按下列要求填空:
①实验操作:
②实验现象:
③有关反应的离子方程式:
0.1 mo1· L-1的盐酸和醋酸分别与过量的镁条(已除掉氧化膜)反应,并用小气球收集产生
的氢气(如下图所示),回答下列问题:
(1)反应前,若用pH试纸检验,则盐酸的pH比醋酸的pH
(填“大”“小”或“相等”),
(2)开始反应时,盐酸和镁反应的速率比醋酸和镁的反应速率
(填“大”、“小”或“相等”),
这是因为
。
(3)充分反应后,两气球中气体的体积大小 (填“基本相等”或“差别很大”),
其原因是 。
30.(共7分)某学生为了对比盐酸与醋酸性质的异同,设计了以下实验:分别取3 mL
29.(共2分)某学生根据已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化
钠溶液时,三次实验分别记录有关数据如下表:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000 mol· L-1盐酸的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
第一次 |
25.00 |
0.00 |
26.12 |
|
第二次 |
25.00 |
0.00 |
26.10 |
|
第三次 |
25.00 |
0.20 |
26.28 |
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)=
28.(文科)(共2分)某学生欲用已知物质的量浓度
的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择
酚酞作指示剂。请填写下列空白:
若滴定开始和结束时,酸式滴定管中的液面如图所示:
则起始读数为 mL,
所用盐酸溶液的体积为 mL。
28.(理科)(共2分)若将pH=2的HCl溶液和0.015 mol ·L一1的Ba (OH)2溶液等体
积混合,所得溶液的pH为 。
26 (共6分)稀氨水存在以下平衡: NH3+H2O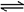 NH3·H2O
NH3·H2O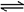 NH4+
+OH-:
NH4+
+OH-:
(1)加入氯化铵晶体,晶体溶解后,平衡 移动(填:“向正反应方向”、“向逆反应方向”、“不”)。溶液的pH将 (填:“增大”、“减小”、“不变”);
(2)加入盐酸,平衡将 移动(填:“向正反应方向”、“向逆反应方向”、“不”)。溶液的中c (H+)将 (填:“增大”、“减小”、“不变”);
(3) 加水稀释,平衡将 移动(填:“向正反应方向”、“向逆反应方向”、“不”)。溶液的中c (OH+)将 (填:“增大”、“减小”、“不变”);
27.(共9分)分别除去下列各物质中的杂质,并按要求填空(“选用试剂”用名称表示):
(1)除去铁粉中混有的少量铝粉,可选用试剂 ,写出该反应的离子方程式:
;
(2)除去FeCl2溶液中混有少量Cu2+,可选用试剂 ,写出该反应的离子方程式:
;
(3)除去NO中混有的少量NO2,可选用试剂 ,写出该反应的化学方程式:
。
第Ⅱ卷 (非选择题 共43分)
24.下列说法正确的是
(A)配制FeCl3溶液时,加人适量盐酸以抑制FeCl3的水解
(B)干电池中的石墨棒是电池的负极
(C)明矾常用作净水剂
(D) Cu-Zn、稀H2SO4的原电池工作时,锌板上有大量的气体逸出,而铜板上无
气体产生
25 下列反应的离子方程式正确的是
(A) 碳酸氢钠水解: HCO3-+H2O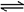 H+
+CO32-
H+
+CO32-
(B) 碳酸电离: H2CO3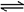 2H+
+CO32-
2H+
+CO32-
(C) 碳酸氢钠溶液与氢氧化钠溶液反应:HCO3-+OH-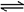 H2O+CO2↑
H2O+CO2↑
(D) 三氯化铝溶液和氨水: Al3+ +3NH3 ·H2O===Al(OH)3↓+3NH4+
请将第Ⅰ卷中各小题正确答案前的字母,填到下表中相应的位置上
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com