
题目列表(包括答案和解析)
16.已知一种c(H+)=1×10-3mol/L的酸溶液和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.等浓度的强酸溶液和强碱溶液反应
B.浓的弱酸溶液和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
15.某原电池的总反应离子方程式为Fe + Cu2+ = Fe2+ + Cu,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为CuSO4溶液
C.正极为Fe,负极为Zn,电解质溶液为CuSO4溶液
D.正极为Ag,负极为Fe,电解质溶液为CuCl2溶液
14.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3¯)都减小,其方法是
A.加入水 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入过量的饱和石灰水溶液
13.在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液
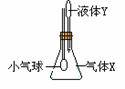 体Y不可能的是
体Y不可能的是
|
|
A |
B |
C |
D |
|
气体X |
NH3 |
SO2 |
CO2 |
HCl |
|
液体Y |
水 |
浓NaOH |
稀H2SO4 |
稀食盐水 |
12. 常温下若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
11.下列离子方程式正确的是
A.向NaAlO2溶液中通入过量的CO2 AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-
B.偏铝酸钠溶液中加入过量盐酸 AlO2-+ 4H+ = Al3++2H2O
C.碳酸钡中加入稀硫酸 BaCO3+2H+ = Ba2++CO2+H2O
D.单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O
10.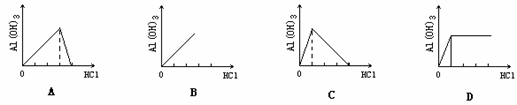 如图,向NaAlO2溶液中滴入盐酸,生成Al(OH)3沉淀的曲线正确的是
如图,向NaAlO2溶液中滴入盐酸,生成Al(OH)3沉淀的曲线正确的是
9.烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物]。下列反应表示整个过程可能发生的变化,其中不符合事实的是
A.2H2O+O2+4e- = 4OH- B.Fe - 3e- = Fe3+
C.Fe2++2OH- = Fe(OH)2 D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
8. 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g)。
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g)。
当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
①混合气体的密度 ②容器内气体的压强
③混合气体的总物质的量 ④B物质的量浓度
A ①和④ B ②和③ C ②③④ D 只有④
7.制取相同质量的Cu(NO3)2时,消耗硝酸质量最多的是
A.铜与浓HNO3反应 B.铜与稀硝酸反应
C.氧化铜与硝酸反应 D.氢氧化铜与硝酸反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com