
题目列表(包括答案和解析)
26.(7分)铁粉和氧化铁粉末的混合物共24.4g, 加入到350mL的稀硫酸中,恰好完全反应,得到氢气1.12L(标准状况),向反应后的溶液中滴入NH4SCN溶液,搅拌均匀,溶液未见红色。
计算:(1)混合物中铁和氧化铁的质量。
(2)原稀硫酸的物质的量浓度。
连云港市2005-2006学年度第一学期期末考试
25、(10分)现有等物质的量的Mg和Al的混合物a g与100 mL盐酸反应,(气体体积均以标准状况计算)
(1)、该混合物中Mg和Al的质量比为
(2)、如果金属与盐酸恰好完全反应,则盐酸的物质的量浓度为
(3)、如果反应后金属有剩余,盐酸不足,要计算生成H2的体积,还需要知道
(4)、若盐酸过量,生成H2的体积为
(5)、若Mg和Al不是以等物质的量混合,则a g混合物与足量盐酸完全反应时生成H2体积(V)的范围是
24.(12分)有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现分别每次取100mL进行实验。请回答有关问题:
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加入足量NaOH溶液后加热,收集到气体0.896L(标准状况);
③向第三份中加入足量的BaCl2溶液,得沉淀6.27g,沉淀经足量盐酸洗涤后,剩余2.33g。(1)判断K+、Cl- 是否存在
(2)肯定存在的离子在原溶液中的物质的量浓度分别是多少?
23.(12分)为了测定某烧碱的纯度(所含杂质不与酸反应),进行如下实验:
①称取5.0g烧碱,配成500 mL溶液。
②取25.00mL所配溶液于锥形瓶内,用0.20 mol/L的盐酸标准溶液进行滴定。试回答:
(1)①实验中,应将烧碱置于 (中或上)并放在托盘天平的 盘,准确称量,配制溶液时应选用的容量瓶是(填编号)___________。
A.50mL容量瓶 B.100mL容量瓶
C.500mL容量瓶 D.1000mL容量瓶
(2)②实验中,标准液盐酸应盛装在 式滴定管中,指示剂可选用 ,滴定终点时指示剂颜色应由 色变为 色。
(3)若两次实验的结果如下,计算该烧碱的纯度为 %。(保留小数点后两位)
|
滴定序号 |
待测溶液体积/mL |
盐酸标准液体积/mL |
|
|
滴定前读数 |
滴定后读数 |
||
|
1 |
25.00 |
0.10 |
26.21 |
|
2 |
25.00 |
0.21 |
26.30 |
(4)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的烧碱纯度值会 (填偏大、偏小、无影响,下同);若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果 ;若滴定前平视读数,滴定终点时俯视读数,则测定结果 。
22.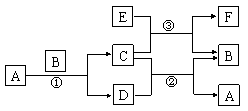 (10分)下图中所涉及的A、B、C、D、E、F都是中学化学教材中常见的物质。反应①②③均在高温下进行。A在常温下为液态,C有磁性,E、F既能溶于NaOH溶液又能溶于HCl溶液。
(10分)下图中所涉及的A、B、C、D、E、F都是中学化学教材中常见的物质。反应①②③均在高温下进行。A在常温下为液态,C有磁性,E、F既能溶于NaOH溶液又能溶于HCl溶液。
(1)A的电子式为 ,
属于 分子(填极性或非极性)
(2)写出反应①的化学方程式:
(3)分别写出E溶于NaOH溶液、HCl溶液反应的离子方程式:
,
(4)③反应原理可用于钢轨焊接,写出其反应的化学方程式:
21.(12分)神舟6号的成功发射,说明我国的空间技术又向前进了一步,宇宙飞船是用肼N2H4(联氨)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式 。
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式 。
(3)发射火箭时肼(N2H4)与N2O4作推力能源,其未配平的反应式为:
N2H4 + N2O4 → N2 + H2O
则 是氧化剂,氧化产物与还原产物物质的量之比为 。
(4)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2 + O2 == 2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2 – 4e- == 4H+ ,则其正极反应式为 ;
碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2 +2H2O +4e- == 4OH- ,则其负极反应式为 。
20.(7分)某温度(t℃)时,水的离子积Kw=1×10-13 ,则该温度(填大于、小于或等于)
25 ℃。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
19. (8分)对于反应:N2+3H2
2NH3(正反应为放热反应),请从以下选项中选择填空(填写编号,多选倒扣分)。
(8分)对于反应:N2+3H2
2NH3(正反应为放热反应),请从以下选项中选择填空(填写编号,多选倒扣分)。
(1)能使反应速率增大的因素有 ,
(2)能使平衡向正反应方向移动的因素有 。
①增大N2或H2的浓度 ②增大压强(缩小容积) ③降低温度 ④加(正)催化剂 ⑤增大NH3的浓度 ⑥减小NH3的浓度 ⑦保持容积不变,充入氩气 ⑧保持压强不变,充入氩气
18.室温下,向20 mL0.1 mol/L的盐酸溶液中逐滴加入0.1 mol/L的氨水至过量,在此过程中,溶液中各离子浓度关系一定错误的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(H+)=c(OH-) C.c(NH4+)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
连云港市2005-2006学年度第一学期期末调研考试
高二化学试题
请将选择题答案填入以下答案栏内
第Ⅱ卷(非选择题 共78分)
17.一定温度下,在一容积不变的密闭容器中,加入a mol NO2,发生2NO2  N2O4反应,一段时间后,达平衡状态甲;接着再加入b mol NO2达平衡状态乙,下列关于甲与乙的说法正确的是
N2O4反应,一段时间后,达平衡状态甲;接着再加入b mol NO2达平衡状态乙,下列关于甲与乙的说法正确的是
A.NO2的转化率甲>乙 B.颜色甲比乙浅
C.N2O4体积分数甲<乙 D.反应速率甲>乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com