
题目列表(包括答案和解析)
26.(2分)
32.现有某镁铝合金的粉末样品,平均分成两份,其中一份加足量的NaOH溶液,产生标准状况下氢气的体积为3.36L,另一份加入足量的稀盐酸,产生标准状况下氢气的体积为4.48L。求原样品中Mg的质量。
**中学2005学年第一学期高二年级第三次过关测试答题卷
化 学(普通班) 2005/12/ 14
14
31.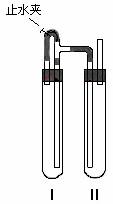 (10分)为制得白色的Fe(OH)2沉淀,采取了如右图的装置,使用了NaOH溶液、铁屑、稀H2SO4等试剂制备。
(10分)为制得白色的Fe(OH)2沉淀,采取了如右图的装置,使用了NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是 。
(2)在试管II里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开 止水夹,塞紧塞子后的实验步骤是
。
(4)若生成的白色Fe(OH)2沉淀接触外界的空气,容易发生的反应的化学方程式为 。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
30.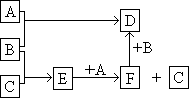 (10分)A、B、C均为单质,B是黄绿色气体,B与C反应后的产物 溶于水得到无色溶液E。B、F、D、E的水溶液均呈酸性, A、B、C之间的其它反应如右图所示:
(10分)A、B、C均为单质,B是黄绿色气体,B与C反应后的产物 溶于水得到无色溶液E。B、F、D、E的水溶液均呈酸性, A、B、C之间的其它反应如右图所示:
(1)写出各物质的化学式。
A 、B 、C
(2)D呈酸性的原因,用离子方程式表示
(3)A单质与D溶液反应的离子方程式为
29.(8分)某化工厂生产中要用到一种无色、可溶于水的晶体--铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵--NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,已知NH4+和AlO2-不能大量共存,会发生反应:
NH4++ AlO2-+H2O==Al(OH)3↓+NH3,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:
① 溶液中出现白色沉淀,白色沉淀量逐渐增多
② 有刺激性气味的气体放出
③ 白色沉淀量逐渐减少,白色沉淀完全消失
请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
①
②
③
28.(5分)生铁(含碳)在潮湿的空气中很容易生锈,是因为发生了 腐蚀,写出电极反应式,正极: ;负极
27.(8分)分子组成为C5H12的同分异构体有:
(写结构简式),上述同分异构体中其一氯取代物只有一种的是 (写名称)。
26.(2分)写出甲基的电子式:
25.现有10.2g镁和铝的混和粉末溶于4mol/L的盐酸500mL中。若加入2mol/L的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100mL B.500mL C.1000mL D.1500mL
试 卷 II
24.既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是
①AgNO3 ②Al(OH)3 ③NH4HCO3 ④NaAlO2 ⑤Al2O3
A.①②③⑤ B.②③④⑤ C.①②④⑤ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com