
题目列表(包括答案和解析)
30.(6分)请用下列所给出的试剂,用三种简便的方法证明一元酸HR是弱酸,简要写出该实验的步骤和应观察到的现象及作出的结论(实验所需的仪器可另选)
限用下列药品:0.1 mol«L-1HCl ,0.1 mol«L-1HR溶液,蒸馏水,pH试纸,锌粒
方法一: ▲
方法二: ▲
方法三: ▲
29.(3分)用正确方法除去括号中的少量杂质,请将所选用的试剂填写在横线上。
(1)FeCl3(FeCl2) ▲ 。
(2)Mg(OH)2(Al(OH)3) ▲ 。
(3)Na2CO3(Na AlO2) ▲ 。
28.(8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示。已知A、B、X均为常见非金属单质。
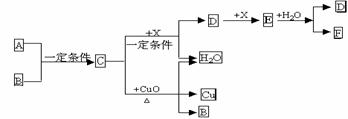
(1)A的分子式为_____▲________;C的电子式为____▲_______________
(2)写出下列反应的化学方程式:C + CuO →:_______ ▲_______________
(3)实验室常用Cu和F的溶液来制备E,你认为F的溶液使用浓的好,还是稀的好。____▲____(填“浓”或“稀”)理由是_____▲_______
27.(6分)有a、b两个极易导热的密闭容器,a保持体积不变,b中的活塞可上下移动以保持内外压强相等。在相同体积下将3molA和1molB分别同时混合于a、b两容器中发生如下反应:3A(g)+B(g) 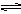 2C(g)+D(g)
2C(g)+D(g)
(1)达到平衡时a中A的浓度为M mol/L,C的浓度为N mol /L, b中A的浓度为m mol/L,C的浓度为n mol/L, 则M ▲ m;N ▲ n (填">"、"<"、"=")
(2)保持温度不变,按下列配比分别充入a、b两容器,平衡后a中的C的浓度仍为N mol/L的是 ▲ ;b中C的浓度仍为n mol/L的是 ▲ 。
A、6molA+2molB B、3molA+2molB
C、2molC+1molB+1molD D、1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入 a中,保持温度不变,平衡时A的浓度为W mol/L, C的为Y mol/L,则W ▲ M,Y ▲ N (填">"、"<"、"=")。
26.(7分)根据题意完成下列各小题:
(1)除去FeCl2溶液中的少量FeCl3杂质,其离子方程式为 ▲ 。
(2)用离子方程式或电离方程式表示NaHCO3溶液中存在的三个平衡: ▲ ;
▲ ; ▲ 。
(3)以四氧化三铁为原料,铝热法制取铁 ▲ 。
(4)写出将AlCl3溶液逐滴加入NaOH溶液中的有关离子方程式 ▲ 。
25、在一些高档食品的包装盒中常常放置一个小袋,小袋内装有灰黑色粉末,一段时问后,有部分粉末会变成棕褐色。若将灰黑色粉末溶于盐酸后取上层清液,滴入几滴氯水,再滴一KSCN溶液,马上出现血红色。以下结论不正确的是
A、小袋中原来装有铁粉 B、小袋中原来装有Fe203
C、该灰黑色粉末用作抗氧化剂 D、该灰黑色粉末不可食用
24.点燃的镁带在SO2中能够象在CO2中那样继续燃烧,但反应较镁和CO2剧烈。反应结束后,在原盛有SO2的集气瓶内壁可能附着的固体有
①MgO ②S ③MgS
A、只有①③ B、只有①② C、只有②③ D、①②③
23.向含下列离子的溶液中,加足量氢氧化钠溶液,静置、过滤,取沉淀洗涤后加足量盐酸,得到的溶液所含金属阳离子与原溶液相同的是
A、Na+、Mg2+ B、Fe2+、Cu2+
C、Al3+、Cu2+ D、Mg2+、Fe3+
22.将铁粉、铜粉、氧化铁粉末的混和物与适量盐酸反应,反应后铁和铜的单质剩余时,溶液中含有的金属阳离子是
A、Fe3+ B、Fe2+ C、Fe2+和Cu2+ D、Cu2+
21.下列离子方程式中,正确的是
A、向氯化亚铁溶液中通入氯气;Fe2++Cl2 Fe3++2Cl-
B、三氯化铁溶液跟过量氨水反应; Fe3++3 OH- Fe(OH)3↓
C、铝条放入氢氧化钠溶液中;2Al+2OH-+2H2O=2AlO2-+3H2↑
D、Na2CO3溶液显碱性;CO32-+H2O=HCO3-+OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com