
题目列表(包括答案和解析)
9.下列各电离方程式中,书写正确的是 ( )

 A.CH3COOH H++CH3COO- B
KHSO4
H++SO42-+K+
A.CH3COOH H++CH3COO- B
KHSO4
H++SO42-+K+

 C H2CO3
2H++CO32- D
NaH2PO4 Na++H2PO4-
C H2CO3
2H++CO32- D
NaH2PO4 Na++H2PO4-
7. 有一处于平衡状态的反应:X(g)+3Y(g)
有一处于平衡状态的反应:X(g)+3Y(g)  2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥
D.②③⑥
8. 反应2X(g)+Y(g)
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥
D.②③⑥
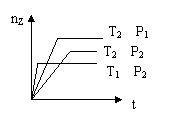
8. 反应2X(g)+Y(g) 2Z(g)+热量,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
( )
2Z(g)+热量,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
6.在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol•L-1,此时间内用H2表示的平均速率为0.45mol•(L•s)-1,则这段时间值是
( )
A.1s
B.0.44s
C.2s
D.1.33s
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol•L-1,此时间内用H2表示的平均速率为0.45mol•(L•s)-1,则这段时间值是
( )
A.1s
B.0.44s
C.2s
D.1.33s
5.可逆反应:N2+3H2
 2NH3的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
2NH3的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
A.3v正(N2)=v逆(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v正(NH3) D.v正(N2)=3v逆(H2)
4.下列变化不能用勒夏特列原理解释的是 ( )
A.红棕色的NO2加压后颜色先变深再变浅 B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时采用循环操作,可提高原料的利用率 D.打开汽水瓶,看到有大量的气泡逸出
2. 可逆反应达到平衡的最主要特征是
( )
A.正逆反应速率相等
B.正逆反应速率均为零
C.正逆反应都还在继续进行
D.反应停止了
3. 在一定条件下,可逆反应 2SO2+ O2 2SO3达到平衡后,充入18O2,则18O将存在于
2SO3达到平衡后,充入18O2,则18O将存在于
A. O2 B. O2、SO3 C. SO2、SO3 D. SO2、O2、SO3
1.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 ( )
A.加热 B.加压 C.加负催化剂 D.加大反应物浓度
33.(6分)在500mLCuSO4和Fe2(SO4)3的混合溶液中加入16.8g铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得6.4g铜。要使滤液中SO42-完全沉淀,需加入2.0mol/LBaCl2溶液500mL。已知Fe3+的氧化性比Cu2+强,求:(1)原混合溶液中SO42-的物质的量浓度。(2)原混合溶液中CuSO4和Fe2(SO4)3的物质的量浓度。
32.(5分)有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入____▲____ mL
(2)如果加入pH = 10的NaOH溶液,应加入__▲____ mL
(3)如果加入0.008 mol/L HCl溶液,应加入___▲_____ mL
31.(9分) 某学生有0.10mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度
(F)调节液面至0或0刻度以下,记下读数
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___▲_____。
(2)上述(B)操作的目的是_____▲______。
(3)实验中用左手控制____▲____(填仪器及部位),眼睛注视____▲_____,直至滴定终点。判断到达终点的现象是____▲_____。
(4)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察碱式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 ▲ 。
②若将锥形瓶用待测液润洗,然后再加入20.00mL待测液,则滴定结果 ▲ 。
③酸式滴定管未用未知浓度的盐酸溶液润洗就直接注入未知浓度的盐酸溶液 ▲ 。
④若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是____▲____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com