
题目列表(包括答案和解析)
2. 根据反应条件判断
当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难易来进行判断,如:
4HCl(浓)+MnO2  MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑
易知氧化性:KMnO4>MnO2。
1. 根据方程式判断
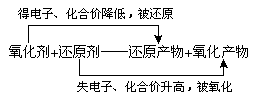
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2. 氧化剂、还原剂之间反应规律
(1)对于氧化剂来说,同族元素的非金属原子,它们的最外层电子数相同而电子层数不同时,电子层数越多,原子半径越大,就越难得电子。因此,它们单质的氧化性就越弱。
(2)金属单质的还原性强弱一般与金属活动顺序相一致。
(3)元素处于高价的物质具有氧化性,在一定条件下可与还原剂反应,在生成的新物质中该元素的化合价降低。
(4)元素处于低价的物质具有还原性,在一定条件下可与氧化剂反应,在生成的新物质中该元素的化合价升高。
(5)稀硫酸与活泼金属单质反应时,是氧化剂,起氧化作用的是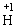 ,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是
,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是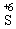 ,被还原后一般生成SO2。
,被还原后一般生成SO2。
(6)不论浓硝酸还是稀硝酸都是氧化性极强的强氧化剂,几乎能与所有的金属或非金属发生氧化还原反应,反应时,主要是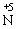 得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
(7)变价金属元素,一般处于最高价时的氧化性最强,随着化合价降低,其氧化性减弱,还原性增强。
氧化剂与还原剂在一定条件下反应时,一般是生成相对弱的还原剂和相对弱的氧化剂,即在适宜的条件下,可用氧化性强的物质制取氧化性弱的物质,也可用还原性强的物质制取还原性弱的物质。
常见的氧化性、还原剂及其还原产物、氧化产物,填写下表
|
氧化剂 |
还原产物 |
还原剂 |
氧化产物 |
|
O2 |
|
活泼金属 |
|
|
Cl2,Br2,I2 |
|
H2 |
|
|
浓H2SO4 |
|
C |
|
|
HNO3 |
|
Si |
|
|
MnO4- |
|
CO |
|
|
Fe3+ |
|
Fe2+ |
|
|
Na2O2,H2O2 |
|
SO2,SO32- |
|
答案:
|
氧化剂 |
还原产物 |
还原剂 |
氧化产物 |
|
O2 |
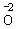 , ,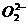 |
活泼金属 |
金属离子 |
|
Cl2,Br2,I2 |
Cl-,Br-,I- |
H2 |
H2O,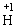 |
|
浓H2SO4 |
SO2,S,H2S |
C |
CO,CO2 |
|
HNO3 |
NO,NO2,NH4+ |
Si |
SiO2,SiCl4 |
|
MnO4- |
Mn2+,MnO2、MnO42- |
CO |
CO2 |
|
Fe3+ |
Fe2+,Fe |
Fe2+ |
Fe3+ |
|
Na2O2,H2O2 |
O2-,H2O |
SO2,SO32- |
SO3,SO42- |
1. 实验分析
(1)Cl2,Br2,I2氧化性的比较。
卤素单质氧化性顺序按F2,Cl2,Br2,I2的顺序逐渐减弱。
[问题讨论]当把Cl2和HBr混合会有何现象?若将碘化钾淀粉试纸置于盛Cl2的集气瓶上一定有变化吗?若想观察到期望的现象应如何操作?若熏久了又会有何现象?
[简析]Cl2可与HBr反应:Cl2+2HBr==2HCl+Br2,可看到有橙红色液滴生成,且Cl2的黄绿色变淡,干燥的碘化钾淀粉试纸与Cl2不反应,因为该反应为离子反应,需在溶液中进行;故需将试纸先用蒸馏水湿润,但熏久了,由于潮湿的Cl2还有另一重要性质--漂白性,会使变蓝的试纸又褪色。
(2)Fe,Fe2+,Fe3+间的氧化还原反应。
Fe与强氧化剂(足量)直接反应可被氧化为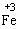 ,而与弱氧化剂(如H+,S等)反应被氧化为
,而与弱氧化剂(如H+,S等)反应被氧化为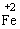 ;且
;且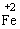 可被强氧化剂(如Cl2,Br2,HNO3、
可被强氧化剂(如Cl2,Br2,HNO3、 )等氧化为
)等氧化为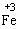 。
。
[问题讨论]
① Fe与浓硫酸反应一定只能得到Fe2(SO4)3吗?
② FeSO4溶液中加溴水可氧化Fe2+为Fe3+,改用氯水、碘水行吗?
③ 铁盐(Fe3+)如何转化为亚铁盐(Fe2+)?向FeCl3溶液中加Cu粉行吗?通入SO2行吗?
④ FeCl3溶液可与KSCN溶液反应而使溶液呈血红色,还有什么溶液也可与FeCl3溶液反应而发生颜色变化?
答:
① 铁过量时得FeSO4。
② 氯水可代替溴水,碘水不行,因:2Fe3++2I-==2Fe2++I2。
③ 加入还原剂可还原Fe3+,Cu粉和SO2均能还原Fe3+得到Fe2+。
④ 苯酚溶液中加入FeCl3溶液呈紫色。
3. 常见的氧化剂、还原剂
(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
① 元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如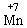 、
、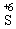 。
。
② 元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如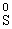 和
和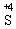 。
。
③ 元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如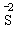 。
。
(2)重要的氧化剂
① 活泼非金属单质,如F2、Cl2、Br2、O2等。
② 元素处于高价时的氧化物、含氧酸、盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③ 过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂
① 活泼的金属单质,如Na,K,Zn,Fe等。
② 某些非金属单质,如H2,C,Si等。
③ 元素处于低化合价时的氧化物,如CO,SO2等。
④ 元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤ 元素处于低化合价时的盐,如Na2SO3,FeSO4等。
2. 氧化还原反应的判断和分析
(1)氧化还原反应的判断
判断一个化学反应是否为氧化还原反应,常根据反应中有无元素的化合价变化(有升有降)来判断。
判断一个反应是否为氧化还原反应的技巧:
① 当有单质参与反应,或有单质生成时可认为该反应一定是氧化还原反应。
② 有机物发生的反应,当分子中引入氧或失去氢可认为被氧化,反之分子中失去氧或得到氢可认为被还原。
(2)氧化还原反应的分析
在氧化还原反应化学方程式里,除了可用箭头表明同一元素原子的电子转移情况外,还可以用箭头表示不同原子的电子转移情况。
用箭头表明同一元素原子的电子转移情况即大家熟悉的“双线桥”。如:
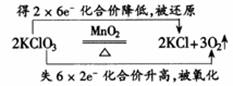
用箭头表示不同原子的电子转移情况--“单线桥”。如:
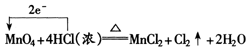
更好地体现了氧化剂和还原剂在反应中的关系。
再如:
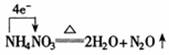
① 单线桥分析氧化还原反应可简单表示为
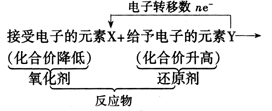
② 反应中电子转移总数等于还原剂给出的电子总数,也必然等于氧化剂接受的电子总数。
1. 氧化还原反应的基本概念
氧化还原反应从化合价的角度来说是指有元素化合价升降的化学反应;从本质上来看则是指有电子转移(得失或偏移)的反应。涉及氧化剂、还原剂、氧化性、还原性等概念。
(1)氧化剂、还原剂的概念及它们在氧化还原反应中关系,及其本质变化及外在表现。
氧化剂是指在反应中得到电子(或电子对偏向)的物质,表现为反应后所含某些元素化合价降低。氧化剂具有氧化性,在反应中本身被还原,其生成物叫还原产物。
还原剂是指在反应中失去电子(或电子对偏离)的物质,表现为反应后所含某些元素化合价升高,还原剂具有还原性,在反应中本身被氧化,其生成物是氧化产物。
(2)氧化剂和还原剂是性质相反的物质
在氧化还原反应中,还原剂把电子转移给氧化剂,即还原剂是电子的给予体,氧化性是电子的接受体。
(3)氧化还原反应中各概念间的关系

29. 用20mLFeCl3溶液腐蚀3.2gCu片,将Cu片完全腐蚀后,加入铁粉2.8g,反应后溶液中存在不溶物1.6g(设反应前后溶液体积变化忽略不计)。计算:
(1)20mL这种溶液中的FeCl3 与多少mL 5mol/L 的FeCl3 溶液中所含FeCl3 的物质的量相等?
(2)反应后溶液中Fe2+的物质的量浓度为多少?
28. 制取氨气并完成喷泉实验(图中夹持装置均已略去)。
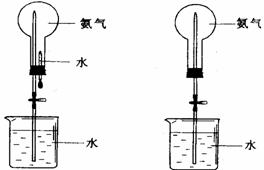
图1 图2
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
答: 。
27.(7分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
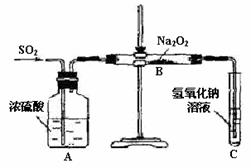
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
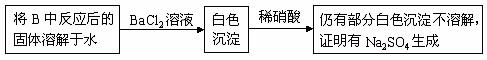
上述方案是否合理?
请简要说明两点理由:① ; ② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com