
题目列表(包括答案和解析)
3. 下列说法中完全正确的是( )
A. 失电子难的原子,其获得电子的能力一定强
B. 在反应中,金属单质只表现还原性,非金属单质只表现氧化性
C. L层比M层多一个电子的元素,其单质一定具有较强的氧化性
D. 有单质参加的化学反应不一定都是氧化还原反应
2. 盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是( )
A. 氧化性 B. 还原性 C. 酸性 D. 金属性
1. 下列说法中,正确的是( )
A. 氧化剂具有氧化性
B. 氧化剂发生氧化反应
C. 氧化剂发生反应后生成氧化产物
D. 氧化还原反应的任何一种反应物不是氧化剂就必定是还原剂
5. 有关氧化还原反应的计算
[例6] 在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑反应中,若有5mol水作还原剂时,则由水还原的BrF3的物质的量为多少?
答案:见解析
解析:对于本题的回答,很多同学会稍加思索后回答为3 mol,该答案是错误的。因为仔细分析本反应就可发现反应物BrF3既作氧化剂,又作还原剂,而H2O只有一部分作还原剂,还有一部分仅作反应物而没有发生化合价的变化。在该反应中3mol BrF3,其中1 mol作还原剂,2 mol作氧化剂,5 mol H2O中只有2 mol H2O作还原剂,也就是在反应中是2 mol H2O、1 mol BrF3共同还原2mol BrF3。因此要回答5 mol H2O还原多少BrF3可从得失电子数目来计算。5 mol H2O共失去电子2e-×5 mol=10 mol e-,而1 mol 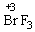 →
→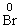 得电子3e-×1 mol=3 mol e-,根据电子守恒则由水还原的BrF3的物质的量为
得电子3e-×1 mol=3 mol e-,根据电子守恒则由水还原的BrF3的物质的量为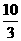 mol。
mol。
a. 判断反应是否属于氧化还原反应,并判断氧化剂、还原剂、氧化产物、还原产物,配平氧化还原反应的方程式,计算电子转移的数目,比较氧化剂的氧化性或还原剂的还原性的强弱,这些常规考点的题型以选择题和填空题为主。
[例7](2002·上海)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg·L-1,现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O,被氧化的元素是_______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:____KOCN+___KOH+___Cl2→____CO2+____N2+____KCl+____H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯_____g。
答案:(1)碳 (2)2,4,3,2,1,6,2 (3)35.5
解析:
(1)在反应KCN+2KOH+Cl2→____KOCN+2KCl+H2O中,碳元素的化合价从+2价上升到+4,失电子,被氧化。
 (2)从KOCN+KOH+Cl2→CO2+N2+KCl+H2O可知,N元素的化合价从-3升至0,而Cl元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得:
(2)从KOCN+KOH+Cl2→CO2+N2+KCl+H2O可知,N元素的化合价从-3升至0,而Cl元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得:
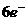
2KOCN+4KOH+3Cl2→2CO2+N2+2H2O+6KCl。
(3)从KCN+2KOH+Cl2→KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2→2CO2+N2+6KCl+2H2O可知2KCN+8KOH+5Cl2→2CO2+N2+10KCl+4H2O即2KCN→5Cl2。
处理上述20L废水,使得KCN完全转化为无毒物质、至少需液氯质量为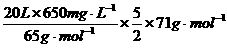 =35.5g
=35.5g
b. 依据质量守恒、电子守恒、电荷守恒等解决一些计算型问题
[例8](2000·全国)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现在NO与NH3的混合物1 mol,充分反应后得产物中经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
答案:
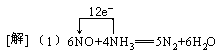
(2)0.3mol NO和0.7mol NH3或0.2mol NH3和0.8mol NO
解析:
(1)略。
(2)6 mol NO还原得到3 mol N2,4 mol NH3氧化得到2 mol N2,两者相差1 mol N2,现相差N2 1.4g,即0.05mol,相当于0.3mol NO和0.2NH3反应。依题意NO和NH3的总质量的量为1 mol, 其中必有一种为过量,所以有两种情况:0.3mol NO和0.7mol NH3;0.2mol NH3和0.8mol NO。
[模拟试题]
4. 氧化还原反应的分析
[例5] 在新生代的海水里有一种铁细菌,它们摄取海水中的Fe2+,把它转变为它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿,这个用酶为催化剂的反应的另一反应物是CO2,它在反应后转变成有机物(用甲醛表示),写出该反应的离子方程式并标出电子转移的方向和数目。
答案:

解析:题意可得,该反应的反应物有Fe2+、CO2等,氧化产物为Fe2O3,还原产物为HCHO,有无其他反应物或生成物呢?我们可以先初步写出一个不完整的方程式:Fe2++CO2--Fe2O3+HCHO,不难看出,由原子守恒可知缺少含H的反应物,那是H+呢还是H2O呢?根据新生代海水中不可能有强酸存在,猜测H2O更合理,于是将上反应进一步写成:Fe2++CO2+H2O--Fe2O3+HCHO,然后进行配平,根据氧化还原方程式配平的一般步骤:① 先考虑电子守恒,配平发生氧化还原反应的氧化剂、还原剂的化学计量数为:4Fe2++1CO2+H2O--2Fe2O3+1HCHO;② 再考虑电荷守恒,使左右两边净电荷相等,易知右边尚缺阳离子,显然为H+。③ 最后考虑原子守恒以观察法配平修正所有物质的化学计量数。
3. 判断氧化剂、还原剂的相对强弱
[例3] 根据下列反应,判断M、N、P、Q的还原性由强到弱的顺序是( )
① NCl2+P=N+PCl2 ② 2MCl3+3N=2M+3NCl2 ③3QCl2+2M=2MCl3+3Q
A. M>N>P>Q B. P>N>M>Q C. Q>P>N>M D. N>M>P>Q
答案:B
解析:根据氧化还原剂反应的规律可知,当一个氧化还原反应按正反应方向进行时,一般情况下,氧化性是:氧化剂>氧化产物;还原性是:还原剂>还原产物。对于反应①,还原剂是P,还原产物N,因此还原性是P>N;对于反应②,还原剂是N,还原产物是M,还原性是N>M,以此类推反应③中还原性M>Q。根据以上关系可得:还原性是P>N>M>Q。
[例4] 现有下列三个氧化还原反应存在:
① 2FeCl3+2KI=2FeCl2+2KCl+I2;
② 2FeCl2+Cl2=2FeCl3;
③ 2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑。
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。下列试剂中,可加入的试剂是( )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
答案:C
解析:可由三个反应方程式得出如下结论:氧化性:MnO4- >Cl2>Fe3+>I2;还原性:Mn2+<Cl-<Fe2+<I-。所以MnO4- 可氧化Cl-、Fe2+、I-,Cl2能氧化Fe2+、I-,只有Fe3+只能氧化I-,因而符合题意的氧化剂只能为C。
2. 氧化剂、还原剂的确定
[例2] 氢阴离子(H-)能和NH3反应:H-+NH3==NH2- +H2↑。根据上述反应事实可以得到的正确结论是( )
A. NH3具有还原性 B. H-是很强的还原剂
C. 该反应的还原产物是H2 D. 该反应属于置换反应
答案:B
解析:液氨中NH3分子能发生如下的电离NH3=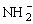 +H+,H-与NH3分子的反应实质上就是H-和NH3分子电离出来的H+发生反应生成H2,由于H-失电子能力强,所以H-是很强的还原剂。NH3分子中的H得到电子,它是氧化剂。H2是H-失电子的氧化产物,也是H+得电子的还原产物,因此H2既是氧化产物又是还原产物。由于该反应中无单质参加,该反应不符合置换反应的定义。
+H+,H-与NH3分子的反应实质上就是H-和NH3分子电离出来的H+发生反应生成H2,由于H-失电子能力强,所以H-是很强的还原剂。NH3分子中的H得到电子,它是氧化剂。H2是H-失电子的氧化产物,也是H+得电子的还原产物,因此H2既是氧化产物又是还原产物。由于该反应中无单质参加,该反应不符合置换反应的定义。
1. 氧化还原反应中电子转移的方向和数目
[例1] 标出反应11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4的电子转移方向和数目,该反应中氧化剂有_______,还原剂为_______,1mol CuSO4中能氧化P原子的物质的量是________。
答案:
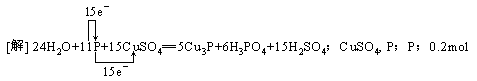
解析:可以先标出有变价的元素的化合价,发现P元素的化合价有升有降,则其既作了氧化剂又作了还原剂,CuSO4中的Cu元素化合价降低,故CuSO4也是氧化剂,因为1mol CuSO4在反应中只有Cu能获得1mol e-,而1mol P被氧化会能出5mol e-,故1mol CuSO4反应氧化0.2mol P。
4. 根据元素周期表判断
(1)同主族元素(从上到下):非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强;金属原子(或单质)还原性逐渐增强,对应阳离子氧化性逐渐减弱。
(2)同周期元素(从左到右):原子或单质还原性逐渐减弱,氧化性逐渐增强。阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。
[典型例题]
3. 由氧化产物的价态高价来判断
当含变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物相关元素价态的高低来判断氧化剂氧化性的强弱。如:
2Fe+3Cl2  2FeCl3
2FeCl3
Fe+S  FeS
FeS
可知氧化性:Cl2>S。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com