
题目列表(包括答案和解析)
20、在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+。则下列判断正确的是( )。
A、混合物里三种物质反应时,消耗盐酸的物质的量之比为1:1:3
B、反应后所得溶液中Fe2+与Cl-物质的量之比为1:2
C、混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D、混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
第Ⅱ卷 非选择题
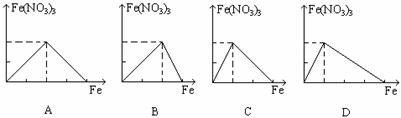
19、下列图象是表示铁跟一定量硝酸反应时, 铁和硝酸铁之间物质的量(mol)的关系, 其中正确的是( )。
18.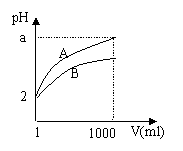 PH=2的A、B两种酸溶液各1ml,分别加水稀释
PH=2的A、B两种酸溶液各1ml,分别加水稀释
到1000ml,其溶液的PH与溶液体积﹝V﹞的关系
如右图所示,则下列说法正确的是( )。
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后A酸溶液的酸性比B酸溶液的强
C、a=5 时,A是强酸,B是弱酸
D、若A、B都是弱酸,则5>a >2
17.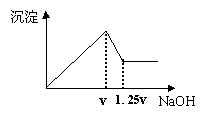 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系
如图所示,则溶液中c(Cl‑)与c(SO42-)之比为( )。
A.1∶1 B.2∶3
C.3∶2 D.2∶1
16.拉曼光谱证实,溶液中不存在AlO2-,实际存在[Al(OH)4] -,0.2mol/L Na[Al(OH)4]溶液200mL与0.2mol/L 250mLH2SO4混合完全反应后,溶液中Al3+与SO42-物质的量之比( )。
A、4:5 B、2:3 C、2:5 D、1:2
15.下列各组物质混合之后,可生成amol沉淀的是 ( )。
A.含amol NaAlO2溶液与amol CO2气体
B.含amol NaAlO2溶液与含amol AlCl3溶液
C.含amol AlCl3溶液与含amol Ba(OH)2的溶液
D.含amol AlCl3溶液与含amol NaOH的溶液
14.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )。
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
13.如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )。
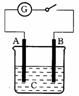 A.A-Cu B-Zn C-
A.A-Cu B-Zn C-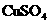
B.A-Ag B-Fe C-HCl
C.A-Zn B-石墨 C-
D.A-石墨 B-Zn C-
12.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出的H2量前者多,其原因可能是( )。
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸③酸溶液的体积大于NaOH溶液的体积 ④ 酸是强酸,浓度比NaOH溶液的大
A、①② B、②③ C、② D、④
10. 下列物质的制备方法正确的是 ( )。 A.用金属钠和氯化钾溶液反应制备金属钾
B.用镁粉和二氧化碳反应可以制备炭粉
C.用铝粉和软锰矿(含MnO2)反应可制得锰
D.用镁粉和空气反应可制得Mg3N2
|
A.AgNO3 B.NH3 H2O C.NaOH D.BaCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com