
题目列表(包括答案和解析)
6.关于小苏打水溶液的表述正确的是 A.c(Na+)=c(HCO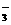 )+c(CO
)+c(CO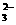 )+c(H2CO3)
)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO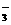 )+c(CO
)+c(CO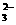 )+c(OH-)
)+c(OH-)
C.HCO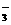 的电离程度大于HCO
的电离程度大于HCO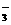 的水解程度
的水解程度
D.存在的电离有:NaHCO3= Na++HCO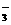 ,HCO
,HCO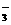 =H++ CO
=H++ CO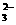
5.将pH=1的某酸溶液和pH=13的某碱溶液等体积混合后,所得溶液中pH
A.大于7 B.小于7
C.等于7 D.以上都有可能
4. 右图表示可逆反应A(g)+B(g)
nC(g)(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是
右图表示可逆反应A(g)+B(g)
nC(g)(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是
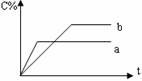 A.a表示有催化剂,而b无催化剂
A.a表示有催化剂,而b无催化剂
B.若其他条件相同,b比a的温度高
C.若其他条件相同,a比b的压强大,n>2
D.反应由逆反应方向开始
3.下列说法中正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
2.在0.01mol/L硫酸溶液中,水电离出的H+浓度是
A.1×10-12mol/L B.0.02mol/L
C.1×10-7mol/L D.5×10-13mol/L
1. 可逆反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下的反应速率如下,其中反应最快的是
可逆反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下的反应速率如下,其中反应最快的是
A.vA=0.5mol/ (L·s) B.vB =0.6mol/ ( L·s)
C.vc=0.4mol/ ( L·s) D.vD=0.45mol/ (L·s)
19.饱和链烃A和不饱和链烃B在常温下均为气体,其中A含有的碳原子数多于B。
(1)将A和B按一定比例混合,1L混合气体完全燃烧后得到3.6LCO2气体,试推断混合气体A和B所有可能的组合及A、B的体积比,并将结果填入下表:
|
编号 |
A的分子式 |
B的分子式 |
VA/VB |
|
① |
|
|
|
|
② |
|
|
|
|
③ |
|
|
|
|
④ |
|
|
|
(2)1mol该混合气体恰好能使含0.4mol溴的四氯化碳溶液完全褪色,推断上表中符合该条件的A、B的分子式,填入下表:
|
A的分子式 |
|
|
|
|
B的分子式 |
|
|
|
(3)120℃时,1LA、1LB与足量O2混合点燃后,在同温、同压下总体积增大2L,试通过计算确定A和B的分子式。
18.某工业反应混合液中仅可能含有的组分是:乙醚(C4H10O)、乙醇和水,经分析,液体中C、H、O的原子数之比为16:42:5。
(1)若混合液中只含2种组分,则所有可能的组合是 。
(2)若混合液中含有3种组分,在628g混合液中有1mol H2O,此时乙醇和乙醚的物质的量各是多少?
17.
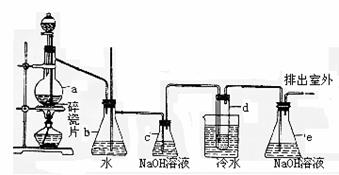 1,2-二溴乙烷可作汽油抗爆剂的添加剂。常温下,它是无色液体,密度为2.18g/cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用所示装置制备1,2-二溴乙烷。图中:分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液;试管d中装有液溴(表面覆盖少量水)
1,2-二溴乙烷可作汽油抗爆剂的添加剂。常温下,它是无色液体,密度为2.18g/cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用所示装置制备1,2-二溴乙烷。图中:分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液;试管d中装有液溴(表面覆盖少量水)
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式: ,
。
(2)安全瓶 b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。
16.(1)区分下列各组有机物(填“操作-现象-判断”)
①1-丙醇和丙三醇
②苯甲醇和苯酚
③乙醇和乙醚
④乙烯、苯、苯酚
(2)除去下物质中的少量杂质(括号内的物质),加入的试剂及操作方法分别为:
①乙醇(水)_______________;②溴乙烷(乙醇)_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com