
题目列表(包括答案和解析)
16.下列混合液中,各离子浓度的大小顺序正确的是
A.10ml0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1-)>c(OH-)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与10mL0.1moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
长郡中学高二年级2006年下学期段考化学试卷
15.在一密闭容器中,等物质的量的A和B发生如下反应:A(g)+2B(g)
 2C(g),反应达到平衡状态时,若混和气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 A.40% B.50%
2C(g),反应达到平衡状态时,若混和气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 A.40% B.50%
C.60% D.70%
14.在一个不传热的固定容积的密闭反应器中,可逆反应mA(g)+nB(g)  pC(g)+qD(g),当m、n、p、q为任意正整数时,达到平衡的标志是
pC(g)+qD(g),当m、n、p、q为任意正整数时,达到平衡的标志是
①体系的压强不再发生改变 ②体系的温度不再发生改变
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率:V(A):V(B):V(C):V(D)=m:n:p:q
⑥单位时间内,若消耗了m mol A物质,同时也消耗了q mol D物质
A.①③⑤ B.①④⑥
C.②③④⑥ D.①②③④⑤⑥
13.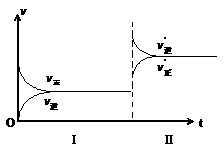
 在密闭容器中,一定条件下进行反应:mA (气)
+ nB (气) pC (气) + qD (气)若增大压强,或升高温度,重新达到平衡,
在密闭容器中,一定条件下进行反应:mA (气)
+ nB (气) pC (气) + qD (气)若增大压强,或升高温度,重新达到平衡,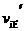 、
、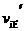 随时间化过程均如下图所示,则对该反应叙述正确的是
随时间化过程均如下图所示,则对该反应叙述正确的是
A.正反应是放热反应,
B.逆反应是放热反应,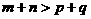
C.正反应是放热反应,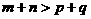
D.逆反应是放热反应,
12.已知常温(25℃)时pH+pOH=14,室温时pH为10的NaOH溶液加热后所得溶液的pOH是
A.大于4 B.小于4
C.等于4 D.无法判断
11.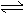 将2molSO2,
1molO2充入带活塞的密闭容器中,发生反应2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
将2molSO2,
1molO2充入带活塞的密闭容器中,发生反应2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
A.保持温度和容器的压强不变,充入1mol SO3(g)
B.保持温度和容器的容积不变,充入1mol SO3(g)
C.保持温度和容器的压强不变,充入1mol O2(g)
D.保持温度和容器的压强不变,充入1mol Ar(g)
10.下列事实不能用勒夏特列原理来解释的是
A.光照新制的氯水时,溶液中酸性逐渐增强
B.加催化剂使N2和H2在一定条件下转化为NH3
C.增大压强,有利于SO2和O2反应生成SO3
 D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
9.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
8.下列叙述正确的是
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
7.合成氨所需的氢气可由水煤气反应制得,其中一步反应为CO(g)+ H2O(g)  CO2(g)+H2(g) (正反应为放热反应),下列措施中能提高CO转化率的是
CO2(g)+H2(g) (正反应为放热反应),下列措施中能提高CO转化率的是
A.增大压强 B.升高温度 C.增大水蒸气的浓度 D.增大CO的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com