
题目列表(包括答案和解析)
6、进行化学实验必须注意安全,下列说法正确的是
A.如果苯酚浓溶液沾到皮肤上,应立即用NaOH溶液洗涤
B.在点燃H2、CH4等易燃性气体前,必须检验气体的纯度
C.实验室制取乙烯时,直接加热烧瓶使液体温度迅速上升到170 ℃
D.不慎将浓硫酸沾到皮肤上,要立即用大量水冲洗
5、做乙醛被Cu(OH)2氧化实验时,有以下步骤:①加入0.5mL乙醛溶液;②加入2%硫酸铜溶液4到5滴;③加入10% NaOH溶液2mL;④加热至沸腾。正确的操作顺序是
A.①②③④ B.③②①④ C.②③①④ D.①③②④
4、下列反应中,不属于取代反应的是
A.乙醇在一定条件下生成乙烯 B.甲烷跟氯气反应生成一氯甲烷
C.苯的硝化反应 D.乙酸乙酯的水解
3、本世纪我国正在建设或即将动工的重大工程很多,其中“南水北调”、“西气东输”等重大工程与人们的生活密切相关,这里的“气”指的是天然气,天然气的产要成分是
A.CO B.石油气 C.H2 D.CH4
2、可以用分液漏斗分离的混合液是
A.乙酸乙酯和水 B.乙醇和乙酸 C.苯和溴苯 D. 四氯化碳和溴
1、下列各组物质中,只用水就能鉴别的是
A.乙醇、乙酸 B.乙醛、乙酸 C.苯、己烯 D.苯、乙酸
24.(2004年·江苏)(10分)石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
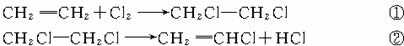
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率= ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2==CH2+4HCl+O2 2CH2Cl-CH2Cl+2H2O ③
2CH2Cl-CH2Cl+2H2O ③
由反应①③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%,试计算:
反应①③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
解析:(1)设生成的氯乙烯和氯化氢质量分别为x、y 。
由反应①②得:
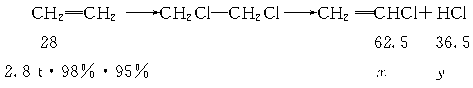
解得:氯乙烯为5.8 t,氯化氢为3.4 t。
(2)设投入反应①、③的乙烯物质的量分别为x、y,则:
由反应①生成的二氯乙烷为x·a%,
由反应③生成的二氯乙烷为y·c%。
则由反应①③共制得二氯乙烷的物质的量为(x·a%+y·c%),通过反应②可获得HCl的物质的量为(x·a%+y·c%)·b%。
据题意,反应③消耗的HCl为2·y·c%,则:
2·y·c%=(x·a%+y·c%)·b%
解得: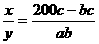
反应①③中乙烯的投料比应为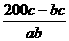 。
。
答案: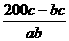
23.(6分)烷烃分子中的基团:-CH3、-CH2-、 中的碳
原子分别称为伯、仲、叔、季碳原子,其数目分别为n1、n2、n3、n4,则烷烃(除CH4外)中存在的关系有(用以上符号回答):
(1)烷烃分子中四种碳原子数之间的关系为n1=__________。
(2)若某烷烃分子中n2=n3=n4=1,则满足此等式的该分子的结构可能有_______种。
解析:烷烃的通式为CnH2n+2,即知C、H原子数的关系。题中烷烃碳原子总数为n1+n2+n3+n4,氢原子总数为3n1+2n2+n3,故有3n1+2n2+n3=2(n1+n2+n3+n4)+2,所以n1=n3+2n4+2。
(2)据(1)知n1=5,则分子式为C8H18。
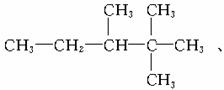
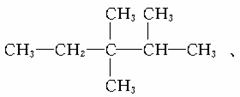
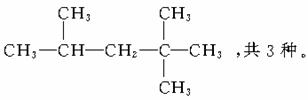
答案:(1)n3+2n4+2 (2)3
22.(12分)聚四氟乙烯的耐热性和化学稳定性都超过了其他塑料,号称“塑料王”,在工业上有广泛的用途。其合成路线如下所示:
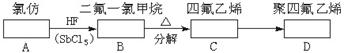
(1)在方框中填入合适的有机物的结构简式。
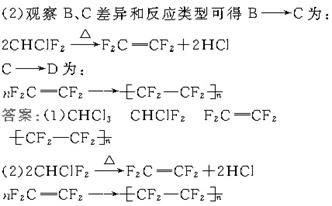
(2)写出下列转化的化学方程式:B C:_______;C
C:_______;C D:_______。
D:_______。
解析:(1)根据合成路线中各物名称可写出A.CHCl3;B.CHClF2;C.F2C==CF2;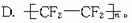
 ?
?
21.(14分)(2002年·上海)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色的浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须除去之,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验_______(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是_______。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(2)乙同学推测此乙炔中必定含有一种杂质气体是_______,它与溴水反应的化学方程式是_______;在验证过程中必须全部除去。
(3)请你选用图2-2所列四个装置(可重复使用)试验乙同学的实验方案,将它们的编号填入方框,并在括号中写出装置内所放的化学药品。
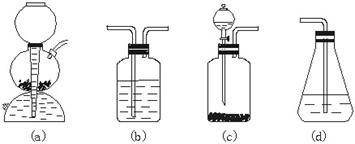
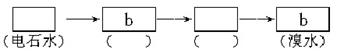
图2-2
(4)为验证这一反应是加成而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是_______。
解析:由实验室制乙炔的原料和反应,可知反应中一般有H2S气体杂质。又知乙炔的典型性质为加成反应,可知通入溴水后,溴水中不会有HBr生成。
答案:(1)不能 a c
(2)H2S Br2+H2S===S↓+2HBr
(3)c b CuSO4溶液 CuSO4溶液
(4)如发生取代反应,必定生成HBr,溶液酸性将明显增强,故可用pH试纸验证
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com