
题目列表(包括答案和解析)
10.已知在pH为4-5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
A.加入纯NaClO固体,调节pH值为4-5
B.向溶液中通入H2S使Fe2+沉淀
C.向溶液中通入Cl2,再通入NH3,调节pH值为4-5
D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4-5
9. pH值相同的四种一元酸A、B、C、D的溶液各20 mL,与过量Mg充分反应后,产生氢气的质量是D>C>A=B。下列说法正确的是:
① D的酸性最强 ② A与B的酸性最强且彼此相当
③ 反应后原D溶液的PH最大 ④ 反应后原A和B溶液的PH最大
⑤ 反应前D溶液的物质的量浓度最大 ⑥ 反应前四种溶液物质的量浓度一样大
A.②③⑤ B.①④⑥ C.②④⑤ D.①③⑤
8.如图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是
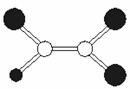 A.该有机物可能的分子式为C2HCl3
A.该有机物可能的分子式为C2HCl3
B.该有机物分子中一定有C=C键
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙炔和氯化氢加成反应得到
7.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
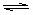 2NO2 (g)。
2NO2 (g)。
下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 消耗速率与NO2生成速率之比为1∶2,③NO2的生成速率与NO2的消耗速率相等,④NO2的物质的量浓度不变,
⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,
⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤ B.⑤⑦⑧ C.②⑤⑦ D.①③④⑥⑧
6.同温同压下,下列各组热化学方程式中,△H1<△H2的是
A.S(g)+O2(g)=SO2(g); △H1 S(s)+O2(g)=SO2(g); △H2
B.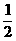 H2(g)+
H2(g)+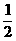 Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.C(s)+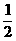 O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
5.纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
4.下列事实不能用勒夏特列原理解释的是
A.实验室配制 溶液时,先将其溶于较浓盐酸中,然后加水稀释
溶液时,先将其溶于较浓盐酸中,然后加水稀释
B.实验室可以用排饱和食盐水的方法收集氯气
C.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉时的快
D.在pH等于3的醋酸溶液中加入少量CH3COONa固体,溶液pH增大
3.在恒温恒容的密闭容器中进行吸热反应:H2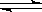 2H,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为
2H,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.大于18s C.等于12s D.小于18s
2.下列各种试纸,使用时预先不能用蒸馏水润湿的是
A.红色石蕊试纸 B.淀粉KI试纸
C.醋酸铅试纸 D.PH试纸
1.“善待地球-科学发展,构建和谐”是“世界地球日”的主题。你认为下列行为中不符合这一主题的是
A.控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
B.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
D.实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com