
题目列表(包括答案和解析)
8、

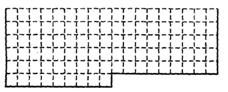
(1)上表中实线是周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期第ⅥA族元素,请在右边方框中按氦元素式样写出甲的原子序数、元素符号、元素名称、相对原子质量和最外层电子排布。
(3)元素乙的3p亚层上只有1个电子,元素丙最内层电子是最外层电子的2倍,且核外p亚层电子比s亚层电子多1个,则三种元素
原子半径比较:_______>______>______(填元素符号,下同);
离子半径比较:_______>______>______;
电负性比较:_______>______>______;
第一电离能比较:_______>______>______。
(4)①用元素符号将甲、乙、丙三种元素填写在上面元素周期表中对应的位置上
②乙、丙两元素相比较,金属性较强的是________(填名称),可以验证该结论的实验是____________
a.将两种元素的块状单质分别放入水中
b.将这两种元素的单质分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别与H2反应观察反应的难易程度
d.比较这两种元素的气态氢化物的稳定性
(5)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的________,请写出元素在周期表中的位置与元素原子结构的关系:
_____________________________________________________________________
_____________________________________________________________________
7、某些化学键的键能如下所示(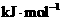 )
)
|
键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
|
键能 |
436 |
193.7 |
152.7 |
242.7 |
431.8 |
298.7 |
366 |
① 在
在 中燃烧,放出热量___________KJ
中燃烧,放出热量___________KJ
②在一定条件下, 与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是_________
与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是_________
A、Cl2>Br2>I2 B、I2>Br2>Cl2
6、氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
(1)写出(CN)2与苛性钠溶液反应的离子方程式_______________________________;
(2)已知氰分子中键与键之间的夹角为180°,并有对称性,
则(CN)2的电子式为____________,结构式为____________________________,
分子空间构型为_______________,是__________分子(填“极性”或“非极性”);
(3)氰分子中碳原子为___________杂化;一个氰分子中包含____________个σ键,_______个π键。
5、请指出下表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并指出中心原子杂化类型。
|
分子 |
空间 构型 |
分子有 无极性 |
中心原子 杂化类型 |
分子 |
空间 构型 |
分子有 无极性 |
中心原子 杂化类型 |
|
O2 |
|
|
|
HF |
|
|
|
|
CO2 |
|
|
|
H2O |
|
|
|
|
BF3 |
|
|
|
NH3 |
|
|
|
|
CCl4 |
|
|
|
BeCl2 |
|
|
|
4、写出下列微粒的电子排布式和轨道表示式。
(1)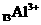 ______________________,_________________________;
______________________,_________________________;
(2)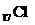 _______________________,_________________________;
_______________________,_________________________;
(3)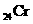 _______________________,_________________________。
_______________________,_________________________。
3、填充合理的量子数,并写出轨道符号。
(1)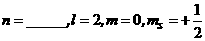 ,轨道符号_______________;
,轨道符号_______________;
(2)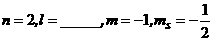 ,轨道符号______________;
,轨道符号______________;
(3)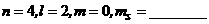 ,轨道符号_______________;
,轨道符号_______________;
(4)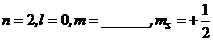 ,轨道符号_______________;
,轨道符号_______________;
(5)四组数据表示的轨道的能量高低顺序为_____>_____>_____>____(填序号)。
2、(1)共价键的_________和_________反映了共价键的强弱程度,_________和_________常被用来描述分子的空间构型;
(2)sp杂化轨道是由一个_________和一个_________组合而成的。每个sp杂化轨道含有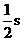 和
和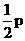 的成分。sp杂化轨道间的夹角为____________,呈____________型,如_______________;
的成分。sp杂化轨道间的夹角为____________,呈____________型,如_______________;
(3)sp3杂化轨道是由一个_________和__________组合而成,每个sp3杂化轨道含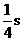 和
和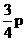 的成分,sp3杂化轨道间的夹角为____________,呈___________型,如_____________。
的成分,sp3杂化轨道间的夹角为____________,呈___________型,如_____________。
1、(1)一般来说,同周期中,除稀有气体元素外,随着原子序数的增大,元素的原子半径自左至右逐渐__________。这是因为每增加一个电子,原子核中相应增加一个正电荷。由于增加的电子分布在同一层上,所以增加的电子产生的电子间的____________作用_________于核电荷增加导致的核对外层电子的有效____________作用,结果使原子半径逐渐减小。
(2)对同主族元素的原子来说,随着原子序数的逐渐增大,原子半径自上而下逐渐_________。这是因为电子层的依次增加,使核电荷增加对电子所施加的影响处于____________地位,电子间的____________作用占了主要地位。
26、在化学上,常用一条短线表示一个化学键,在下面的有关结构中,直线(包括虚线)不全表示化学键或分子间作用力的是( )
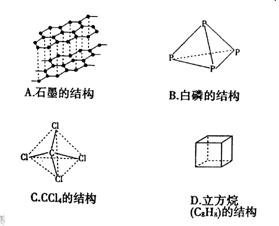
第II卷(非选择题,共48分)
25、下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是( )
A、核内无中子的原子
B、电子构型为3S23P1
C、最外层电子数等于倒数第三层上的电子数的原子
D、N层上无电子,最外层上的电子数等于电子层数的原子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com