
题目列表(包括答案和解析)
3.铁片投入下列溶液后,金属片质量减少,但无气体放出的是:
A 冷、浓HNO3 B Cu(NO3)2 溶液 C 稀HNO3 D Fe(NO3)3溶液
2.能说明镁比铝还原性强的事实是:
A Mg的价电子比铝少
B 镁带在空气中和CO2中能燃烧,而铝不能
C Mg遇浓硫酸不钝化,而铝钝化
D 铝的硬度、延展性、熔点均比镁大、好、高
1.铝和镁比较,铝的硬度较大,熔点和沸点较高.这是因为
A 镁的核电荷数较大,原子量较大
B 镁离子和自由电子的作用力较弱
C 铝离子所带的正电荷比镁离子的多
D 铝的原子半径较大
2.吸氧腐蚀:
通常情况下,酸性较强的水溶液环境是不多见的,我们所见的水溶液一般都是弱酸性、中性或弱碱性的,因此析氢腐蚀并不普遍。在弱酸性、中性或弱碱性的环境中是不是钢铁就不发生腐蚀呢?事实并非如此。因为水溶液中溶解有一定量的氧气,而氧气是一种强的氧化剂,具有较强的得电子能力,在这样的环境中氧气将在碳极上得到电子,使钢铁腐蚀仍然发生。电极反应式如下:
负极(Fe): Fe-2e-= Fe2+
正极(C) : O2+2H2O+4e-=4OH-
由电极反应式可知,在这种环境中,铁仍然作负极被溶解,但碳作负极吸收了氧气,反应过程中生成了OH-。因为吸收了氧气,因此这些环境中的腐蚀叫吸氧气腐蚀。
注意:
铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al+6H2O==2Al(OH)3+3H2↑ NaOH+Al(OH)3==NaAlO2+2H2O
 6e-
6e-
2Al+6H2O+2NaOH==2NaAlO2+4H2O+3H2↑
上式可简写为:2Al+2H2O+2NaOH==2NaAlO2+3H2↑
巩固练习
1.析氢腐蚀:
空气中有大量的CO2腐蚀:气体(也含有其它的酸性气体),CO2溶于水后将使溶液表现出酸性,如果在酸性较强的环境中,就构成了Fe、C、含H+的电解质溶液的原电池,电极反应式如下:
负极(Fe): Fe - 2e- = Fe2+ 正极(C) : 2H+ + 2e-= H2↑
由电极反应式可知,铁作负极被溶解,碳作正极有H2放出,反应过程中将消耗H+。因为有H2放出,所以将这种环境中发生的钢铁腐蚀叫析氢腐蚀。
3.把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连,可组成原电池。a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则其金属活动性
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
电化学腐蚀:
0.1mol/LAgNO3 0.1mol/LAgNO3 0.1mol/LAgNO3 0.1mol/LAgNO3
A B C D
2.下列各装置中接入的灯泡的功率相同,则灯泡最亮的是
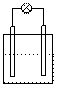
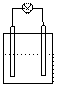
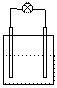
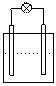 Zn C Fe C
Sn C Cu C
Zn C Fe C
Sn C Cu C
1.在下列各装置中,溶液质量增大的是
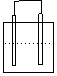
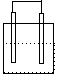
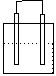
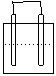 Cu Zn Cu Ag
Fe C
Fe Zn
Cu Zn Cu Ag
Fe C
Fe Zn
稀H2SO4 稀AgNO3 稀H2SO4 稀AgNO3
A B C D
2.电极反应式:
在上述原电池中,负极上锌失去电子,用电极反应式表示为Zn-2e=Zn2+正极上铜离子得到电子,用电极反应式表示为Cu2++2e=Cu。
练习
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com