
题目列表(包括答案和解析)
4、下列物质在水溶液中存在着电离平衡的是…………………………………………….……( )
A.HF B.HNO3 C.C2H5OH(酒精) D.Na2SO4
3、在CH3COOH溶液中存在如下平衡:CH3COOH 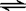 H++CH3COO-,加入少量下列物质能使平衡向左移动的是……………………………………………………………………..………( )
H++CH3COO-,加入少量下列物质能使平衡向左移动的是……………………………………………………………………..………( )
A.NaCl B.CH3COONa C.Na2CO3 D.NaOH
2、物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是………………………………( )
A.NH4Cl B.NaCl C.CH3COONa D.NaNO3
1、下列说法正确的是 ……………………………………………………………………………( )
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
40、FeCl2(FeCl3)
(6分)41、欲将Ag+、Al3+、Mg2+、K+四种离子一一分离,应加入的试剂(按顺序写,试剂之间用箭头隔开)是 。 42、欲将Ba2+、Mg2+、Al3+ 、Ag+四种离子一一分离,应加入的试剂(按顺序写,试剂之间用箭头隔开)是 。 配平下列化学方程式 (4分)43、[ ]Fe(OH)3+ [ ]NaOH+[ ]Cl2→[ ]Na2FeO4+ [ ]NaCl+ [ ]H2O 44、[ ]Fe + [ ]HNO3(极稀)→[ ]Fe(NO3)3+ [ ]NH4NO3+ [ ]H2O 三、计算题 (12分)45、将镁、铝合金3.9g和足量盐酸反应,产生4.48L氢气(S.T.P)求:(1)合金中镁、铝的质量百分含量各是多少?(2)反应后的溶液中需要加入多少升5mol/L的氢氧化钠溶液,才能使生成的沉淀全部是氢氧化镁? 46、将铁、铝合金5.5g和足量盐酸反应,产生4.48L氢气(S.T.P)求:(1)合金中铁、铝的质量百分含量各是多少?(2)反应后的溶液中需要加入多少升4mol/L的氢氧化钠溶液,才能使生成的沉淀全部是氢氧化亚铁? (注意:请写明题号)
(注意:前面的题目全部完成的同学方可考虑做以下试题) 附加题: 1、某学生根据Cl2可作消毒剂以及绿矾(FeSO4·7H2O)可作净水剂的知识,设计了简单的净水流程,其中A、B两种物质分别是直接起消毒和净水作用的主要成分。
(1)生成Fe3+的离子方程式为 ,物质B的化学式为 (2)用化学方程式表示液氯可作消毒剂的原因 物质A的化学式为 (3)绿矾能作净水剂的原因是 。 2、将10.2g的氧化铝溶于一定浓度的500ml的盐酸溶液中,充分反应后,再逐滴加入1mol/L的NaOH溶液,反应过程中生成沉淀的质量与加入NaOH溶液的体积关系如图所示。求: (1)盐酸的物质的量浓度 (2)最大沉淀的量 (3)当沉淀从最大值到恰好全部消失时,耗用多少mlNaOH?
39、FeCl3(FeCl2)
38、AlCl3 (FeCl3)
27.(6分)将100 mL H2、C2H6和CO2的混合气体与300 mL O2混合点燃,经充分反应并干燥后,总体积减少100 mL。再将剩余的气体通过碱石灰吸收,体积又减少100 mL。( 上 述体积均在同温同压下测定)求原混合气体中各组分的体积。
26.(8分)电石中的碳化钙和水能完全反应:
CaC2+2H2O=C2H2+Ca(OH)2
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积比,从而可测定电石中碳化钙的含量。
 (1)
若用下列仪器和导管组装实验装置:
(1)
若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是______接_______接______接______接_______接_______。
(2) 仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
① 称取一定量电石,置于仪器3中,塞紧橡皮塞。
② 检查装置的气密性。
③ 在仪器6和5中注入适量水。
④ 待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤ 慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是 。
(3) 若实验产生的气体有难闻的味,且测定结果偏大,这是因为电石中含有__________杂质。
(4) 若实验时称取的电石为1.60 g,测量排出水的体积后,折算成标准状况乙炔的体积为448 mL,此电石中碳化钙的百分含量是________%。
25.(5分)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成m mol CO2和n mol HO。则
(1) 当m=n时,该烃是
(2) 当m=2n时,该烃是
(3) 当2m=n时,该烃是
(4) 当4m=7n时,该烃是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com