
题目列表(包括答案和解析)
电解质溶液中有关离子浓度的判断
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌握“两平衡、两原理”,即弱电解质的电离平衡、盐的水解平衡和电解质溶液中的电荷守恒、物料平衡原理。现将此类题的解题方法做如下总结。
3.盐类水解的利用:
(1)物质制造要考虑盐的水解。
(2)盐溶液的配制要考虑盐的水解。
(3)盐溶液中离子浓度的比较要考虑盐的水解。
(4)判断盐溶液酸碱性要考虑盐的水解。
2.水解规律:
(1)盐类水解程度一般很小。
(2)水解规律:有弱才水解,无弱不水解,都弱都水解。谁强显谁性,两强显中性,两弱具体定。
(3)影响因素:溶液越稀越水解,温度越高越水解,酸碱越弱越水解。
1.盐类水解的实质:盐电离出的离子与水电离出的H+或OH-结合生成弱电解质,从而促进水的电离。
3.D 4.C 5.B 6.C
2.①BD ②BD ③BCD
1.FeCl3溶液
6.下列物质中分别滴入适量的溴水,不发生化学反应的是
[ ]
A.FeCl2溶液 B.碘化钾溶液
C.甲苯 D.苯酚溶液
答案:
5.下列化合物中,既不能跟盐酸反应,又不能跟KOH溶液反应,也不能被酸性KMnO4溶液氧化的是 [ ]
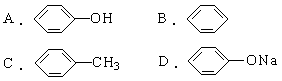
4.鉴别甲苯、苯酚溶液、乙烯、碘化钾淀粉溶液、硝酸银溶液等五种无色液体的一种试剂是 [ ]
A.KMnO4酸性溶液 B.FeCl3溶液
C.溴水 D.金属钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com