
题目列表(包括答案和解析)
3.两盐混合既促进水解又促进电离的讨论:
如将0.1 mol·L-1的NaHCO3溶液(pH均为8)与同物质的量浓度的NaAlO2溶液(pH约为11)等体积混合,只产生白色沉淀Al(OH)3而无气体产生。其原因是:AlO 和HCO
和HCO 都可以水解,且溶液均为碱性,但AlO
都可以水解,且溶液均为碱性,但AlO 水解程度大于HCO
水解程度大于HCO :
:

 AlO
AlO +2H2O Al(OH)3+OH- HCO
+2H2O Al(OH)3+OH- HCO +H2O H2CO3+OH-
+H2O H2CO3+OH-
使得NaHCO3水解不仅受到限制而且又促进如下反应:HCO +OH-====CO
+OH-====CO +H2O的发生,因此上述盐溶液的混合是既促进了AlO
+H2O的发生,因此上述盐溶液的混合是既促进了AlO 的水解,又促进了HCO
的水解,又促进了HCO 的电离。同理AlO
的电离。同理AlO 的水解可促进HS-、HSO
的水解可促进HS-、HSO 、H2PO
、H2PO 等的电离;PO
等的电离;PO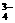 的水解与H2PO
的水解与H2PO 的电离也可互相促进。
的电离也可互相促进。
2.两种盐溶液混合促进水解的讨论
盐溶液混合能相互促进水解且趋于完全时称之为双水解。并不是所有的弱酸盐和弱碱盐溶液相混合都能发生双水解反应。因为弱酸阴离子水解可使溶液呈碱性即:
 An-+H2O HA-(n-1)+OH-
An-+H2O HA-(n-1)+OH-
弱碱阳离子水解可使溶液呈酸性即:
 Bm++mH2O B(OH)m+mH+
Bm++mH2O B(OH)m+mH+
当弱酸阴离子和弱碱阳离子同在一水溶液中时,其水解可相互促进,但这只是具备发生双水解反应的必要条件。溶液中存在弱酸HA-(n-1)与弱碱B(OH)m、H+与OH-发生中和反应的两种趋势,若HA-(n-1)与B(OH)m反应趋势大于H+与OH-反应趋势时,则双水解反应不能发生;反之发生双水解反应,即双水解反应的充分条件是水解产生的弱酸和弱碱不再发生中和反应。只有具备充分必要条件时才能发生双水解反应。如Al3+与CO 、HCO
、HCO 、SiO
、SiO 、AlO
、AlO 、SO
、SO 、HSO
、HSO 、S2-、HS-、ClO-等;Fe3+与CO
、S2-、HS-、ClO-等;Fe3+与CO 、HCO
、HCO 、SiO
、SiO 、AlO
、AlO 、ClO-等;NH
、ClO-等;NH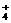 与AlO
与AlO 、SO
、SO 等均能发生趋于完全的双水解反应。
等均能发生趋于完全的双水解反应。
1.对盐类水解程度的理解:
盐类水解反应是中和反应的逆反应,即:
酸+碱 盐+水
盐+水
不论从酸、碱反应开始,还是从盐水解反应开始,一定条件下都能达到平衡。若盐的水解程度对某化学现象的产生起积极作用,则考虑盐的水解;若盐的水解程度对化学现象的产生不起积极作用,则不考虑水解。盐的水解程度主要决定于盐的结构,次要决定于外部条件。
中和反应的趋势(强对强易反应、强对弱能反应,弱对弱慢反应)越大,程度越深,则水解反应的趋势(两强不水解,强弱能水解,两弱易水解)越小,程度越浅。见下表:
某些盐的水解情况
|
名称 |
0.1 mol·L-1溶液 |
|
|
h(水解度) |
pH |
|
|
NH4Cl CH3COONa NaHCO3 Na2CO3 CH3COONH4 |
0.0085% 0.0085% 0.048% 4.2% 0.56% |
5.1 8.8 8 11.6 ≈7 |
由此可见,对一般盐(特别是强酸弱碱盐和强碱弱酸盐)通常情况下水解趋势不大,其逆反应(中和反应)趋势较大。对0.1 mol·L-1 Na2CO3溶液碱性已较强,但水解程度仅有4.2%。对一般弱酸弱碱盐类通常情况下水解程度也较小,如0.1 mol·L-1 CH3COONH4溶液水解度只有0.56%。所以,通常考试的水解只决定溶液的酸碱性和溶液中离子浓度(或排序问题)。
但有部分弱酸弱碱盐水解程度较大,如Al2(CO3)3、Al2S3、(NH4)2S等,由于它们的阴阳离子水解产物是易挥发的气体或沉淀,离开平衡体系而促进水解反应进行完全。如:
2Al3++3S3-+6H2O====2Al(OH)3↓+3H2S↑
因此,Al2(CO3)3、Al2S3几乎百分之百完全水解,不能存在于水溶液中。(NH4)2S溶液的水解度高达99.9%。
解此类题的关键是抓住溶液呈中性(即阴、阳离子所带电荷总数相等)及变化前后原子的个数守恒两大特点。若题中所给选项为阴阳离子的浓度关系,则应考虑电荷守恒;若所给选项等式关系中包含了弱电解质的分子浓度在内,则应考虑物料守恒。
[例8]表示0.1 mol·L-1 NaHCO3溶液中有关粒子浓度的关系正确的是( )
A.c(Na+)>c (HCO )>c (CO
)>c (CO )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
B.c(Na+)+
c (H+)= c (HCO )+ c (CO
)+ c (CO )+ c (OH-)
)+ c (OH-)
C. c (Na+)+
c (H+)= c (HCO )+2 c
(CO
)+2 c
(CO )+ c (OH-)
)+ c (OH-)
D. c (Na+)=
c (HCO )+ c (CO
)+ c (CO )+ c (H2CO3)
)+ c (H2CO3)
解析:A.NaHCO3溶液因为水解大于电离而呈碱性,因此c(OH-)>c(H+)。
B.应考虑电荷守恒,c(CO )前应乘以2。
)前应乘以2。
C.电荷守恒符合题意。
D.含弱电解质分子应考虑物料守恒。在NaHCO3溶液中存在下列关系:
NaHCO3====Na++HCO
 HCO
HCO H++CO
H++CO
 HCO
HCO +H2O H2CO3+OH-
+H2O H2CO3+OH-
则c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)符合题意。
)+c(H2CO3)符合题意。
故选C、D。
此类元素守恒题中各粒子之间的关系一般为:(以下二元弱酸的酸式盐为例)
c(不变化的离子)=c(变化的离子)+c(水解后生成的弱电解质)+c(电离所得二元弱酸根离子)
4.强酸强碱盐与弱碱或弱酸混合
解析方法同3
3.强酸弱碱盐与强酸混合
[例7]0.2 mol·L-1CH3COOK与0.1 mol·L-1的盐酸等体积混合后,溶液中下列粒子的物质的量关系正确的是( )
A.c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
解析:两溶液混合后CH3COOK+HCl====KCl+CH3COOH,又知CH3COOK过量,反应后溶液中CH3COOK、CH3COOH和KCl物质的量相等。由于CH3COOH的电离和CH3COO-的水解程度均很小,且CH3COOH的电离占主导地位,因此c(CH3COO-)>c(H+)>c(OH-)。
又知c(Cl-)=0.05 mol·L-1,c(CH3COO-)>0.05 mol·L-1,c(CH3COOH)<0.05 mol·L-1。
因此选项中D是正确的。
2.强碱与弱酸混合
[例6]pH=x的NaOH溶液与pH=y的CH3COOH溶液,已知x+y=14,且y<3。将上述两溶液等体积混合后,所得溶液中各离子浓度由大到小顺序正确的是( )
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
解析:同例5,pH=x的NaOH溶液中,c(OH-)=10-(14-x)mol·L-1,pH=y的CH3COOH溶液中,c(H+)=10-ymol·L-1,因为x+y=14。NaOH中c(OH-)等于CH3COOH中c(H+)。因此c(CH3COOH)远大于10-ymol·L-1,CH3COOH过量,因此选项中B正确。
上述两题的特点是pH1+pH2=14,且等体积混合。其溶液中各离子浓度的一般关系是: c(弱电解质的离子)>c(强电解质的离子)>c(显性离子)>c(水电离出的另一离子)
解此类题的关键是抓住两溶液混合后生成的盐的水解情况以及混合时弱电解质有无剩余,若有剩余,则应讨论弱电解质的电离。下面以一元酸,一元碱和一元酸的盐为例进行分析。
1.强酸与弱碱混合
[例5]pH=13的NH3·H2O和pH=1的盐酸等体积混合后所得溶液中各离子浓度由大到小的排列顺序是 。
解析:pH=1的HCl,c(H+)=0.1 mol·L-1,pH=13的NH3·H2O,c(OH-)=0.1
mol·L-1,则NH3·H2O的浓度远大于0.1 mol·L-1。因此两溶液混合时生成NH4Cl为强酸弱碱盐,氨水过量,且c(NH3·H2O)>c(NH4Cl),则溶液的酸碱性应由氨水决定。即NH3·H2O的电离大于NH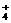 的水解,所以溶液中的离子浓度由大到小的顺序应为:
的水解,所以溶液中的离子浓度由大到小的顺序应为:
c(NH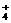 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
注:强酸弱碱盐溶液中加入一定量的弱碱解题方法与此题相同。
解此类题的关键是抓住盐溶液中水解的离子。
[例2]在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是( )
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
解析:在CH3COONa溶液中
CH3COONa====Na++CH3COO-
 CH3COO-+H2O CH3COOH+OH-
CH3COO-+H2O CH3COOH+OH-
而使c(CH3COO-)降低且溶液呈现碱性,则c(Na+)>c(CH3COO-),c(OH-)>c(H+),又因一般盐的水解程度较小,则c(CH3COO-)>c(OH-),因此A选项正确。
一元弱酸盐溶液中离子浓度的一般关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
[例3]在Na2CO3溶液中各离子的浓度由小到大的排列顺序是
解析:在Na2CO3溶液中
Na2CO3====2Na++CO
 CO
CO +H2O HCO
+H2O HCO +OH-
+OH-
 HCO
HCO +H2O H2CO3+OH-
+H2O H2CO3+OH-
CO 水解使溶液呈现碱性,则c(OH-)>c(H+),由于CO
水解使溶液呈现碱性,则c(OH-)>c(H+),由于CO 少部分水解,则c(CO
少部分水解,则c(CO )> c(HCO
)> c(HCO ),HCO
),HCO 又发生第二步水解,则c(OH-)>c(HCO
又发生第二步水解,则c(OH-)>c(HCO ),第二步水解较第一步弱的多,则c(HCO
),第二步水解较第一步弱的多,则c(HCO )与c(OH-)相差不大,但c(H+)比c(OH-)小的多,因此c(HCO
)与c(OH-)相差不大,但c(H+)比c(OH-)小的多,因此c(HCO )>c(H+)。此题的结论应为:c(H+)<c(HCO
)>c(H+)。此题的结论应为:c(H+)<c(HCO )<c(OH-)<c(CO
)<c(OH-)<c(CO )<c(Na+)
)<c(Na+)
二元弱酸盐溶液中离子浓度的一般关系是:c(不水解离子)>c(水解离子)>c(显性离子)>c(二级水解离子) >c(水电离出的另一离子)
[例4]判断0.1 mol·L-1的NaHCO3溶液中离子浓度的大小关系。
 解析:因NaHCO3====Na++HCO
解析:因NaHCO3====Na++HCO HCO
HCO +H2O H2CO3+OH-
+H2O H2CO3+OH-
 HCO
HCO H++CO
H++CO
NaHCO3的水解程度大于电离程度,因此溶液呈碱性,且c(OH-)>c(CO )。由于少部分水解和电离,则c(Na+)>c(HCO
)。由于少部分水解和电离,则c(Na+)>c(HCO )>c(OH-)>c(CO
)>c(OH-)>c(CO )
)
又由于HCO 电离产生H+与CO
电离产生H+与CO 数目相同,而H2O电离也可产生H+,因此c(H+)>c(CO
数目相同,而H2O电离也可产生H+,因此c(H+)>c(CO ),则NaHCO3溶液离子浓度由大到小的排列顺序为:c(Na+)>c(HCO
),则NaHCO3溶液离子浓度由大到小的排列顺序为:c(Na+)>c(HCO )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO )
)
二元弱酸的酸式盐溶液中离子浓度大小的一般关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)>c(电离得到的酸根离子)
解此类题的关键是紧抓弱酸的电离平衡。
[例1]0.1 mol·L-1的H2S溶液中所存在离子的浓度由大到小的排列顺序是 。
解析:在H2S溶液中有下列平衡:

 H2S H++HS- HS- H++S2-
H2S H++HS- HS- H++S2-
已知多元弱酸的电离以第一步为主,第二步电离较第一步弱得多,但两步电离都产生H+,因此答案应为:c(H+)>c(HS-)>c(S2-)>c(OH-)
弱酸溶液中离子浓度大小的一般关系是:
c(显性离子)>c(一级电离离子)>c(二级电离离子)>c(水电离出的另一离子)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com