
题目列表(包括答案和解析)
5.向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是( )
A.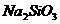 B.
B.
C.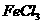 D.
D.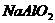
4.同温同压下,足量的镁分别在下列相同体积的气体中燃烧,所得固体产物质量最大的是( )
A.空气
B.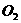
C.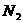 D.
D.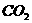
3.甲、乙、丙、丁分别是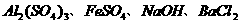 四种物质中的一种.若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失.丁溶液滴入甲溶液时,无明显现象发生.据此可推断丙物质的是( )
四种物质中的一种.若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失.丁溶液滴入甲溶液时,无明显现象发生.据此可推断丙物质的是( )
A.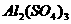 B.
B.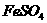
C.NaOH
D.
2.无色透明的溶液中可能含有大量的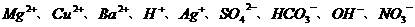 等离子.若向其中加入铝粉,反应后生成
等离子.若向其中加入铝粉,反应后生成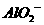 离子,则原溶液中可能存在的离子是(
)
离子,则原溶液中可能存在的离子是(
)
A.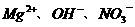 B.
B.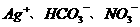
C.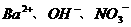 D.
D.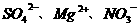
1.某些化学试剂可以用于净水.水处理中使用的一种无机高分子混凝剂的化学式可以表示为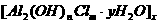 式中m等于( )
式中m等于( )
A.3-n B.6-n
C.6+n D.3+n
1、化学平衡的概念是本节教学的重点,但由于它比较抽象,学生较难接受,所以它又是教学的难点。为此,建议在教学过程中注意以下几点:
(1)化学平衡研究的对象是可逆反应。学生在高一时已学过可逆反应:①可逆反应是在同一条件下能同时向正、逆两个方向进行的反应;②可逆反应不能进行到底,因而对于任何一个可逆反应都存在一个反应进行到什么程度的问题。
(2)抓住可逆反应在一定条件下,各物质浓度的变化和反应速率的变化情况,提出问题,设置知识台阶,引导学生积极思维,建立化学平衡概念。
(3)为了加深学生对化学平衡概念的理解,可引导学生精读化学平衡的定义,着重注意定义中的“一定条件”“可逆反应” “正反应和逆反应的速率相等”“反应混合物中各组成成分的质量分数不变”的重要涵义。明确化学平衡研究的对象是“可逆反应”,并具有“动”(即正反应和逆反应的速度相等,平衡是动态的而不是静止的)、“定”(即反应混合物中各组成成分的百分含量保持不变)、“变”(即当条件改变时,原平衡就要受到破坏)的特征,让学生明确化学平衡状态定义中内因与外因的关系(外界条件改变时,v(正)≠v(逆),平衡被破坏;外界条件一定时,v(正)=v(逆),平衡建立),动与静的关系(正反应和逆反应仍在不断进行,而各组分的质量分数保持不变),现象与本质的关系[v(正)=v(逆)是化学平衡的本质,各组分的质量分数保持不变是现象],从而培养学生的辩证唯物主义观点。
13、在某温度下,将2 mol A和3 mol B充入密闭容器中发生反应aA(g)+B(g) 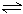 C(g)+D(g),5 min后,达到平衡,各物质平衡浓度(mol·L-1)的关系为:{c(A)}a·c(B)}=C(C)·C(D),若在温度不变的情况下,将容器的体积扩大为原来的5倍,若A的转化率不发生变化,则B的转化率为__________。
C(g)+D(g),5 min后,达到平衡,各物质平衡浓度(mol·L-1)的关系为:{c(A)}a·c(B)}=C(C)·C(D),若在温度不变的情况下,将容器的体积扩大为原来的5倍,若A的转化率不发生变化,则B的转化率为__________。
分析:因为{C(A)}a·C(B)=C(C)·C(D)
容积扩大5倍,A的转化率未变,可知a=1
设B的转化率为x
A(g) +
B(g) 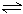 C(g) + D(g)
C(g) + D(g)
起始 2mol 3mol
转化 3·x 3·x 3x 3x
平衡 2-3x 3-3x 3x 3x
(2-3x)(3-3x)=3x·3x
x=40%
答案:B的转化率为40%
12、在一个固定容积的密闭容器中,保持一定温度,进行以下反应,H2(g)+Br2(g)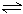 2HBr(g),已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr,在相同条件下,且保持平衡时,各组分的质量分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g),已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr,在相同条件下,且保持平衡时,各组分的质量分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
|
编号 |
起始状态(mol) |
平衡时HBr的 物质的量(mol) |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
(1) |
0.5 |
1 |
0 |
|
|
(2) |
|
|
1 |
0.5a |
|
(3) |
n |
M(m≥2n) |
|
|
在(3)的推算过程中,设起始状态时HBr的物质的量为x,平衡时HBr的物质的量为y,则x的表达式为x=_________,y的表达式为y=________(用m、n表示)
答案:(1)0.5 a
(2)0,0.5
(3)2(m-2n),(m-n)
11、当化学反应PCl5(g)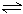 PCl3(g)+Cl2(g)处于化学平衡状态时,向其中加入一种37Cl含量较多的氯气,平衡发生移动,在建立新平衡以后,PCl3(g)中所含37Cl的质量分数比原平衡状态时是否会增加?理由是___________。
PCl3(g)+Cl2(g)处于化学平衡状态时,向其中加入一种37Cl含量较多的氯气,平衡发生移动,在建立新平衡以后,PCl3(g)中所含37Cl的质量分数比原平衡状态时是否会增加?理由是___________。
答案 会增加,因为反应是可逆的,首先加入含37Cl较多的氯气,会使反应向左进行,使PCl5中37Cl的含量增多,而PCl5又分解,使PCl5中37Cl的含量增多。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com