
题目列表(包括答案和解析)
32.(7分)
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________。
31.(7分)
(1)这些装置的连接顺序(按气体从左到右的方向)是
____→ ____→____ →_____→____→____→_____→______→(填各接口的编号)。
(2)实验时甲装置的作用是______________________________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是_____________________________________________________。
(4)(Ⅳ)处观察到的现象是__________________________________________________________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_______________________________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为________________________________。
30.(8分)
⑴ b电极材料应为__________,电极反应式为_____________________________。
⑵ 电解液C可以是_____________________________________________。
⑶ d为苯,其作用是______________,在加入苯之前对C应作何简单处理___________
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是_____________________。
⑸ 混合物中另一明显现象为___________________________________________。
29.(5分)
(1)请你预测K元素与Na元素的x的大小关系__________________________
(2)简述11-17号元素x值与原子半径的关系是
(3)x值的大小与元素的金属性或非金属性强弱之间的关系是______________________________
(4) <x(Mg)< , <x(N)< .
28.(6分)
 (1) KClO3
+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
(1) KClO3
+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
(2)浓盐酸在反应中显示出来的性质是_______
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)消毒的效率是Cl2的_______倍。
27.(8分)
(1)大试管内碳酸盐的化学式是_________________;碱石灰的作用是________________。
(2)<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是_____________________________。
<2>原因__________________________________________________________
(3)<1>两气体通入的先后顺序是_____________________,其理由是___________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
33.(7分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量以17.0计,水的密度以1.00 g/cm3计)
第二学期高二化学期中试卷(实验班)
一,选择题(每小题只有一个答案,每题2分,共52分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
32.(7分)某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为__________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________。
31.(7分)请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
|
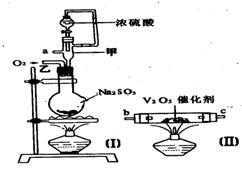
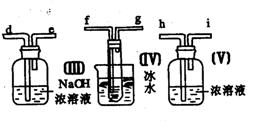
(1)这些装置的连接顺序(按气体从左到右的方向)是
____→ ____→____ →_____→____→____→_____→______→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是________________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
30.(8分)由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
⑴ b电极材料应为____,电极反应式为________________。
⑵ 电解液C可以是__________。
A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d为苯,其作用是______________,在加入苯之前对C应作何简单处理___________
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是________。
A.改用稀硫酸作电解液 B.适当增大电源的电压。
C.适当减小两电极间距离 D.适当降低电解液的温度。
⑸ 若C中用Na2SO4溶液,当电解一段时间看到白色Fe (OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com