
题目列表(包括答案和解析)
1.我国研制的大型激光器“神光二号”用了磷酸二氢钾(KH2PO4)晶体。下列说法正确的是
A.磷酸二氢钾也可用作复合肥料 B.磷酸二氢钾是一种氧化物 ( )
C.磷酸二氢钾中含有氢分子 D.磷酸二氢钾中磷元素为+4价
21.为测定某氯化钠、碳酸钠固体混合物的组成,小明同学取16g该混合物放入烧杯中,分五次加入稀盐酸(每次加入稀盐酸的质量为25g),待反应完全后,得到下面的质量关系:
|
加入稀盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
烧杯及其反应后混合物的总质量/g |
122.2 |
146.1 |
170.0 |
193.9 |
218.9 |
请分析以上数据后计算:
(1) 原固体混合物中碳酸钠的质量。
(2) 当加入稀盐酸至固体混合物恰好完全反应时,所得溶液的溶质质量分数。(结果精
确到0.1g)
20.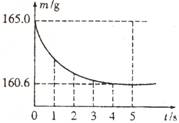 在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应。反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始总质量为165.0g。
在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应。反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始总质量为165.0g。
试回答下列问题:
(1)完全反应时产生二氧化碳的质量为_______g。
(2)原混合物中氯化钠的质量。
(3)反应后所得溶液的溶质质量分数。
18.溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃)
|
溶液中溶质的质量分数(%) |
4 |
12 |
16 |
24 |
28 |
|
硫酸溶液的密度(g·mL-1) |
1.02 |
1.08 |
1.11 |
1.17 |
1.20 |
|
氨水的密度(g·mL-1)) |
0.98 |
0.95 |
0.94 |
0.91 |
0.90 |
请仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐__________(填“增大”、“减小”或“不变”),氨水的密度逐渐________(填“增大”、“减小”或“不变”);
(2)取12%的硫酸溶液100g配制成6%的溶液,向100g12%的硫酸溶液中加水的质量应________100g(填“大于”、“小于”或“等于”);
(3)向100g24%的氨水加入100g水,摇匀,溶液体积是________mL。(保留到0.1)。
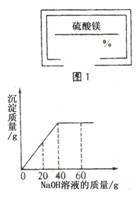 19.某同学在实验室发现一瓶标签残缺(如图1所示)的溶液。
19.某同学在实验室发现一瓶标签残缺(如图1所示)的溶液。
为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加
入溶质质量分数为 10%的NaOH溶液。反应过程中生成沉淀的质量与所
用NaOH溶液质量的关系如下图所示。请计算此溶液的溶质质量分数。
17.溶液的碱性强弱跟溶液中OH-的浓度有关。一定体积的溶液中OH-数量越多,则溶液碱性越强。10%的NaOH溶液(密度为1.1g·cm-3)与10%的KOH溶液(密度也为1.1g·cm-3)相比较,碱性更强的是_____________;要使上述碱溶液的pH减小,你准备采用的物理方法是_______;化学方法是_______________________________。
16.我国化工专家候德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
|
|
0℃ |
20℃ |
40℃ |
60℃ |
|
NaHCO3 |
6.9 |
9.6 |
12.7 |
16.4 |
|
NaCl |
35.7 |
35.8 |
36.6 |
37.3 |
|
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
(1)从表中数据可以看出,温度对______的溶解度影响不大。
(2)要使NH4Cl饱和溶液中的NH4Cl结晶析出,在________(填“较高”或“较低”)温度下进行比较合适。
(3)“侯氏制碱法”制NaHCO3的方程式是NaCl+CO2+NH3+H2O= NaHCO3+ NH4Cl,该反应能进行的原因是_______________________。
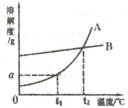
15.下图是固体物质甲的溶解度曲线:
(1)图中A点代表甲的________溶液。(填“饱和”或“不饱和”)
 (2)请填写下表剩余空格。(在表的第1、2、3栏内选填“变大”、
(2)请填写下表剩余空格。(在表的第1、2、3栏内选填“变大”、
“变小”或“不变”;在第4栏内选择“饱和”或“不饱和”)。
|
过程 |
1 |
2 |
3 |
4 |
|
降低温度 |
溶剂质量 |
溶质质量 |
溶质质量分数 |
溶液状态 |
|
A→B |
|
|
不变 |
B点_________ |
|
B→C |
不变 |
|
|
C点_________ |
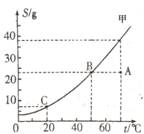
14.A、B两种固体物质的溶解度曲线如右图所示。请回答:
(1)t1℃时,A物质的溶解度为_________g。
(2)t2℃时,A、B两种物质的溶解度_________。
(3)我国有些地区有一种说法:“冬天捞碱,夏天晒盐。”
这里的碱是指Na2CO3,盐是指NaCl。那么,图中________(填
“A”或“B”)的溶解度曲线与Na2CO3的溶解度曲线相似。人们用上述方法从盐湖中捞得的Na2CO3中会有少量NaCl。某研究性学习小组称取含NaCl的Na2CO3固体12.5g,将其配成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到4.4gCO2气体,则原固体中Na2CO3的质量分数为____________%。
13.用“>”“<”“=”填空:
(1)V1mL水和V2mL酒精混合后,溶液体积_________(V1+V2) ml。
(2)某一温度下,NaCl的溶解度为Sg,则在此温度下NaCl饱和溶液的溶质质量分数________S%。
 (3)20℃时,饱和石灰水的溶质质量分数为a%,0℃饱和石灰水溶质质量分数为b%,则a_____b。
(3)20℃时,饱和石灰水的溶质质量分数为a%,0℃饱和石灰水溶质质量分数为b%,则a_____b。
12.右图表示M、N两种固体物质的溶解度曲线。有关图示信息描述正确的是( )
A.
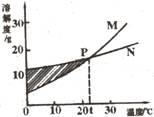 20℃时,M的溶解度大于N的溶解度
20℃时,M的溶解度大于N的溶解度
B.M、N都不是易溶物质
C.P点表示M、N均为饱和溶液
D.阴影处M、N均为饱和溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com