
题目列表(包括答案和解析)
16.下列已达平衡状态的各反应体系,若再增大压强或升高温度,都能使平衡向正反应方向移动的是(Q>0) ( )
A. CaO(s)+CO2(g)≒CaCO3(s)-Q B.Cl2(g)+CO(g)≒COCl2(g)+Q
C.2NH3(g)≒N2(g)+3H2(g)-Q D.N2(g)+O2(g)≒2NO(g)+Q
28、 在常温下,在容积为2L的密闭容器中充入1molNO2,当反应2NO2
N2O4进行2min时达到平衡,测知有0.8molNO2转化为N2O4,试求平衡时:
在常温下,在容积为2L的密闭容器中充入1molNO2,当反应2NO2
N2O4进行2min时达到平衡,测知有0.8molNO2转化为N2O4,试求平衡时:
(1)、用N2O4表示在2min内反应的平均速率是多少?
(2)、N2O4的物质的量;
(3)、混合气体的相对分子质量。
第一学期期中考试试卷
15、 在一定条件下,发生CO+NO2
CO2+NO的反应,达到化学平衡后,降低温度,混合物颜色变浅,下列有关该反应的说法正确的是
(
)
A、正反应为吸热反应
B、正反应为放热反应
C、降温后CO的浓度增大
D、降温后各物质的浓度不变
16、下列各反应达到化学平衡后,增大压强会使平衡向正反应方向移动的是( )
A、2NO2(g)
N2O4(g)
B、C(S)+CO2(g) 2CO(g)
C、H2S(g)
H2(g)+S(S)
D、4NH3 (g) + 5O2(g)
4NO(g)+6H2O(g)
17、下列说法正确的是
(
)
A、可逆反应的特征是正反应速率和逆反应速率相等
B、在其他条件不变时,升高温度可以使化学平衡向放热反应方向移动
C、在其他条件不变时,增大压强一定会破坏有气体存在的反应的平衡状态
D、在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化
学平衡状态
18、合成氨时采用500℃左右的温度进行,主要是因为在该温度时 ( )
A、合成氨的化学反应速率最大
B、N2的转化率最高
C、催化剂的活性最大
D、NH3的浓度最大
19、决定化学反应速率的主要因素是
(
)
A、物质的浓度
B、反应温度
C、物质的性质
D、压强
20、反应A+3B=====2C+3D在四种不同的情况下的反应速率为:①v(A)=0.10mol/(L·s);②v(B)=0.45mol/(L·s);③v(C)=0.30mol/(L·s);v(D)=0.30mol/(L·s),该反应在四种情况下进行的快慢顺序是
(
)
A、②>④>③>①
B、④>③=②>①
C、①>③>④>②
D、②=③>①=④
二、非选择题(本题60分)
21、氮分子的电子式是
,结构式为
;磷原子核外有
个电子,其最高价氧化物的水化物的化学式为
。(每空2分)
22、实验室分别制备:H2、NO2、CH4、NO气体时, 只能用排水法收集的气体是
_____; 只能用排空气法收集的气体是_______; 既能用排水法又能用
空气法收集的气体是_________。(每空1分)
23、影响化学反应速率的主要外界因素有 、
、 和催化剂
等。在其他条件不变的情况下,减小生成物的浓度的瞬间,可以使正反应
速率
,逆反应速率
。(每空1分)
在一定条件下,发生CO+NO2
CO2+NO的反应,达到化学平衡后,降低温度,混合物颜色变浅,下列有关该反应的说法正确的是
(
)
A、正反应为吸热反应
B、正反应为放热反应
C、降温后CO的浓度增大
D、降温后各物质的浓度不变
16、下列各反应达到化学平衡后,增大压强会使平衡向正反应方向移动的是( )
A、2NO2(g)
N2O4(g)
B、C(S)+CO2(g) 2CO(g)
C、H2S(g)
H2(g)+S(S)
D、4NH3 (g) + 5O2(g)
4NO(g)+6H2O(g)
17、下列说法正确的是
(
)
A、可逆反应的特征是正反应速率和逆反应速率相等
B、在其他条件不变时,升高温度可以使化学平衡向放热反应方向移动
C、在其他条件不变时,增大压强一定会破坏有气体存在的反应的平衡状态
D、在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化
学平衡状态
18、合成氨时采用500℃左右的温度进行,主要是因为在该温度时 ( )
A、合成氨的化学反应速率最大
B、N2的转化率最高
C、催化剂的活性最大
D、NH3的浓度最大
19、决定化学反应速率的主要因素是
(
)
A、物质的浓度
B、反应温度
C、物质的性质
D、压强
20、反应A+3B=====2C+3D在四种不同的情况下的反应速率为:①v(A)=0.10mol/(L·s);②v(B)=0.45mol/(L·s);③v(C)=0.30mol/(L·s);v(D)=0.30mol/(L·s),该反应在四种情况下进行的快慢顺序是
(
)
A、②>④>③>①
B、④>③=②>①
C、①>③>④>②
D、②=③>①=④
二、非选择题(本题60分)
21、氮分子的电子式是
,结构式为
;磷原子核外有
个电子,其最高价氧化物的水化物的化学式为
。(每空2分)
22、实验室分别制备:H2、NO2、CH4、NO气体时, 只能用排水法收集的气体是
_____; 只能用排空气法收集的气体是_______; 既能用排水法又能用
空气法收集的气体是_________。(每空1分)
23、影响化学反应速率的主要外界因素有 、
、 和催化剂
等。在其他条件不变的情况下,减小生成物的浓度的瞬间,可以使正反应
速率
,逆反应速率
。(每空1分)
 24、反应2SO2+O2
2SO3,在定温、定容的密闭容器中进行。SO2和O2的最初
浓度分别为3mol/L和2mol/L,达到平衡时有80%的SO2参加了反应,平衡
时各物质的浓度分别是c(SO2)= ,c(O2)=
,c(SO3)
=
。(每空3分)
25、配平下面氧化还原反应方程式:(每空1分)
( ) KMnO4+( )H2S+( )H2SO4---( )MnSO4+( )K2SO4+( )S↓+( )H2O
其中氧化剂是______, 被氧化的元素是______, 电子转移的总数是_______。
26、如图所示,实验室用NH4Cl和Ca(OH)2制取干燥的NH3
。试回答下列问题:
24、反应2SO2+O2
2SO3,在定温、定容的密闭容器中进行。SO2和O2的最初
浓度分别为3mol/L和2mol/L,达到平衡时有80%的SO2参加了反应,平衡
时各物质的浓度分别是c(SO2)= ,c(O2)=
,c(SO3)
=
。(每空3分)
25、配平下面氧化还原反应方程式:(每空1分)
( ) KMnO4+( )H2S+( )H2SO4---( )MnSO4+( )K2SO4+( )S↓+( )H2O
其中氧化剂是______, 被氧化的元素是______, 电子转移的总数是_______。
26、如图所示,实验室用NH4Cl和Ca(OH)2制取干燥的NH3
。试回答下列问题:
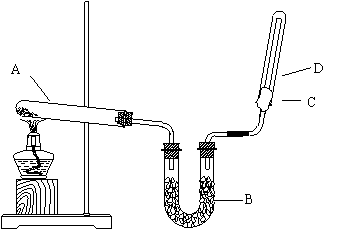
(1)写出NH3的电子式 和结构式 。(每空2分) (2)B处为干燥装置,应放置的药品是 。(2分) (3)用向下排空气法收集NH3时,C处棉花上应蘸取 。(1分)

 (4 ) 试管A发生的化学方程式为
____________________________________________。(3分)
27、用硫铁矿(主要成分是FeS2,杂质不参与反应)制取硫酸,再用硫酸制取化肥硫酸铵[(NH4)2SO4]。今燃烧含FeS2 80%的硫铁矿100t,生产出132.0t硫酸铵。若在制取硫酸铵时硫酸的利用率为100%,试求FeS2转化为H2SO4的转化率。(发生的主要化学反应为4FeS2+11O2 高温 2Fe2O3+8SO2,2SO2+O2400℃`500℃
2SO3,
SO3+H2O=====H2SO4)(本题8分)
(4 ) 试管A发生的化学方程式为
____________________________________________。(3分)
27、用硫铁矿(主要成分是FeS2,杂质不参与反应)制取硫酸,再用硫酸制取化肥硫酸铵[(NH4)2SO4]。今燃烧含FeS2 80%的硫铁矿100t,生产出132.0t硫酸铵。若在制取硫酸铵时硫酸的利用率为100%,试求FeS2转化为H2SO4的转化率。(发生的主要化学反应为4FeS2+11O2 高温 2Fe2O3+8SO2,2SO2+O2400℃`500℃
2SO3,
SO3+H2O=====H2SO4)(本题8分)
14、


 某混合气体12g,在标准状况下占体积5.6L,则该混合气体的平均相对分子质量是: ( )
A 24
B 48
C 36
D 72
某混合气体12g,在标准状况下占体积5.6L,则该混合气体的平均相对分子质量是: ( )
A 24
B 48
C 36
D 72
12、反应4NH3 (g) + 5O2(g) 4NO(g)+6H2O(g),密闭容器中进行,1分钟后水蒸汽的物质的量浓度增加了0.6 mol/L,则此反应的平均速率v(x)(反应物的消耗速率或生成物的生成速率)可表示为: ( ) A.v(NH3)= 0.30 mol/(L·min) B.v(O2)= 0.50 mol/(L·min) C.v(NO )= 0.30 mol/(L·min) D.v(H2O )= 0.50 mol/(L·min) 13、在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( ) A、A、B、C三者的化学反应速率之比为1:3:2

 B、单位时间内生成amolA,同时生成3amolB
B、单位时间内生成amolA,同时生成3amolB
C、A、B、C的浓度不再变化
D、A、B、C的浓度相等
29. (7分)在 500ml CuSO4和Fe2(SO4)3的混合溶液中加入16.8克铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得6.4克铜。要使滤液中SO42-完全沉淀,需加入2.0mol∕L BaCl2溶液500ml。已知Fe3+的氧化性比Cu2+强,求
(1)溶液中SO42-的物质的量浓度
(2)原混合溶液中硫酸铜的物质的量浓度
28.(4分)含碳为83.3%的烷烃进行取代反应后得到的一氯代物只有一种。该烷烃的结构简式为:
,名称为: 。
27.(4分)某无色透明溶液里加入铝粉可放出氢气,试分析下列离子:H+、Ba2+、Mg2+、、OH- 、SO32- 、Cl-、CO32-、NO3-中可能有哪些离子存在于该溶液中;
第一种情况:若溶液呈酸性,可能大量存在的离子是 ;
第二种情况:若溶液呈碱性,可能大量存在的离子是 。
25.(9分)有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
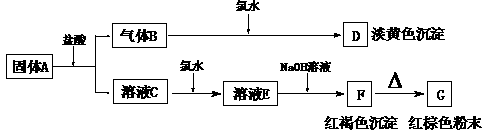
(1)写出下列物质化学式
A B C D E F G ;
(2)写出下列变化的离子方程式:
A®B+C
C®E
24.(8分) 写出下列各有机物的名称或结构简式
(1) 分子内含有14个H原子的直链烷烃 。
(2) 侧链中含有乙基的烷烃中分子量最小的是 。
(3) 2, 4, 6–三甲基–5–乙基辛烷 。
(4) 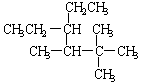 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com