
题目列表(包括答案和解析)
25.(3分)浓度均为0.1 mol·L-1的8种溶液①HNO3,②H2SO4,③CH3COOH,④Ba(OH)2,

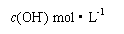 ⑤CH3COONa,⑥NaOH,⑦KCl,⑧NH4Cl溶液的pH由小到大的顺序是(填编号)
⑤CH3COONa,⑥NaOH,⑦KCl,⑧NH4Cl溶液的pH由小到大的顺序是(填编号)
。
24. (12分)某学生设计了一个制取氢氧化
(12分)某学生设计了一个制取氢氧化
亚铁的最佳实验方案,实验装置见图,请
分析实验过程:
⑴在B试管中加入NaOH溶液后加热煮沸
1-2分钟立即加入2mL液体石蜡,该
操作目的是____________________________。
⑵在具支试管A中加入稀H2SO4溶液和略微
过量的铁粉,分析为什么铁粉过量_____
____________________。
⑶连接好导管,同时打开活塞,当铁粉与稀
硫酸反应平稳时,关闭活塞,这时A试
管中的现象为____________________________,
原因是_______ 。
B试管中现象为__ 。
⑷如B中产生的氢氧化亚铁遇空气,发生变化
的化学方程式为______________________________________。
23.(6分)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入
CuSO4 溶液。
⑴片刻后可观察到的现象是(指悬吊的金属圈) 。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
⑵ 产生上述现象的原因是____________________________
__________________________________________________________________________。
22.用铂电极电解500mL含KNO3和Cu(NO3)2两种溶质的混和溶液,一段时间后在两个电极上均生成11.2L气体(标准状况下)。则原溶液中铜离子的物质的量浓度为
A.0.5 mol·L-1 B.1 mol·L-1
C.1.5 mol·L-1 D.2 mol·L-1 高二化学第一学期期末调研测试试题
高 二 化 学
|
第Ⅰ卷答题栏 |
第Ⅱ卷(非选择题 共72分)
21.有一包白色固体可能是NaOH、Na2CO3、NaHCO3一种或两种组成,取一定量固体溶于水配成溶液,用一定浓度的标准盐酸进行滴定分析:先用酚酞作指示剂,达终点时消耗盐酸V1mL;接着用甲基橙作指示剂,达终点时消耗盐酸V2mL。若V1>V2,则白色固体的成分是
A.Na2CO3 B.NaHCO3 C.NaHCO3和Na2CO3 D.NaOH和Na2CO3
20.镍镉充电电池,电极材料是Cd和NiO(OH),电解质是氢氧化钾,电极反应是:
Cd+2OH- -2e=Cd(OH)2, 2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,下列说法不正确的是
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池的总反应式是:Cd+2NiO(OH)+ 2H2O=Cd(OH)2+2Ni(OH)2
C.电池充电时,镉元素被还原
D.电池充电时,电池的正极和电源的正极连接
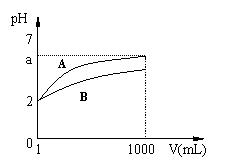
19.pH=2的A、B两种酸溶液各lmL,分别加水
稀释到1000 mL,其溶液的pH与溶液体积(V)的
关系如右图所示,则下列说法正确的是
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则5>a>2
18.在500℃时,相同体积的甲、乙两容器,甲容器中充入1g SO2和1g O2,乙容器中
充入2g SO2和2g O2,发生反应并达平衡,下列有关叙述中的不正确是
A.反应速率:乙>甲 B.平衡时O2的浓度:乙>甲
 C.SO2的转化率:乙>甲
D.平衡时SO2的体积分数:乙>甲
C.SO2的转化率:乙>甲
D.平衡时SO2的体积分数:乙>甲
17. 用标准浓度的NaOH溶液来滴定未知浓度的盐酸,在下列操作中,会使盐酸测定浓度偏大的是
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③移液管用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察滴定管读数时,视线高于刻度线
A. ②③ B. ①③ C. ①④ D. ④⑤
16.下列事实不能用化学平衡移动原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制氨气
D.增大压强,有利于SO2与O2反应生成SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com