
题目列表(包括答案和解析)
3.在温度不变时,恒容器中进行反应,H2?2H-Q,若反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间应为( )
A.10 s B.12 s C.大于12 s D.小于12 s
2.在可逆反应中,混合物各成份的浓度比,一定等于各物质的分子系数比的是( )
A.起始浓度 B.转化浓度 C.平衡浓度 D.都不等于
1.改变下列条件,一定会使气体反应的化学反应速率加快的是( )
①增加反应物的浓度 ②加入催化剂 ③升高温度 ④缩小气体的体积
A.①②③ B.①③④ C.②④③ D.③
25.为了测定某铜银合金的成份,将30.0 g合金溶于80 mL 13.5 mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72 L(标况),并测得溶液的pH=0。假定反应的体积仍为80 mL,试计算:
(1) 被还原HNO3的物质的量;
24.依据氧化还原反应:KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
① 称量绿矾样品,配成100 mL待测溶液,② 取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③ 将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④ 滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2-3次。
(1) 配平上述氧化还原反应方程式______________________;
(2) 若生成0.4 mol Fe2(SO4)3,则反应中转移电子的物质的量为______________;
(3) 下列每种量器的数量不限,在上述实验中,必须使用的有_____________;
A.托盘天平 B.量筒 C.容量瓶 D.碱式滴定管 E.酸式滴定管
23.已知25℃时n种物质的电离度(溶液浓度均为0.1 mol/L)如下表
①H2SO4溶液中 |
②NaHSO4溶液中 |
③CH3COOH |
④HCl |
|
10% |
29% |
1.33% |
100% |
已知H2SO4的电离为H2SO4=H++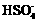 ,
,
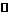 H++
H++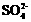
(1) 25℃时,0.1 mol/L上述几种溶液中c (H+)由大到小的顺序为(填序号)_____________。
(2) 25℃时,pH相同的上述四种溶液,其物质的量浓度由大到小的顺序为____________。
(3) 25℃时,将足量的Zn粉放入等体积,pH=1的上述四种溶液中,产生的体积由大到小的顺序为___________。
(4) 25℃时,0.1 mol/L的H2SO4溶液中,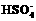 的电离度小于0.1 mol/L NaHSO4溶液中
的电离度小于0.1 mol/L NaHSO4溶液中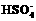 的电离度的原因是___________________。
的电离度的原因是___________________。
22.(1) 体积相同,pH相同的盐酸和醋酸溶液,分别与足量的颗粒大小相同的Zn反应,开始产生H2的速率_____________,充分反应后产生H2的量____________________________,原因是_____________________。
(2) 在一定量的盐酸中加入足量的Zn粒,要使产生H2的量保持不变,但反应速率减慢,可加入________晶体,理由是___________。
21.(1) 将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈______(填碱性,酸性或中性),其原因是(用离子方程式表示)___________________。
(2) 已知CH3COONH4溶液为中性,又知CH3COOH加入Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH_____7(填大于、小于或等于);将同温下等浓度的三种盐溶液(A.NH4HCO3、B.CH3COONH4 C.(NH4)2CO3)按pH由大到小的顺序排列___________。
20.甲同学向自制少量的Mg(OH)2浑浊液中加入浓NH4Cl溶液,结果沉淀完全溶解;乙同学向自制少量的Mg(OH)2浑浊液中加入浓CH3COONH4溶液,结果沉淀也完全溶解。试用有关理论解释这些事实_______________________________________________。
19.室温时,pH=3的醋酸与pH=13的NaOH溶液等体积混合,恰好完全反应,则此时醋酸的电离度为______;若在一定温度下,pH=a的醋酸与pH=b的NaOH溶液等体积混合,亦恰好完全反应,则该醋酸的电离度可表示为_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com