
题目列表(包括答案和解析)
23.把9.2 g N2O4晶体放在密闭容器中加热到一定温度,当反应N2O4(气)?2NO(气)达到平衡后,混合气体的密度是相同条件下H2的密度28.75倍,求N2O4的转化率。
22.炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)?Fe(固)+CO2(气)-Q,其平衡常数表达式 ,已知1100 ℃时,K=0.263。
,已知1100 ℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比_________,平衡常数K值_________;
(2)100 ℃时,测得高炉中[CO2]=0.025 mol/L,[CO]=0.1 mol/L。在这种情况下,该反应是否处于平衡状态________,(填是或否)。此时,化学反应速率是v正 ______v逆(填大于,小于或等于),其原因是________________。
21. 在硫酸工业生产中,通过下列反应使SO2转化为SO3,2SO2+O2 SO3+Q,已知常压下SO3的体积分数为91%,试回答下列问题:
在硫酸工业生产中,通过下列反应使SO2转化为SO3,2SO2+O2 SO3+Q,已知常压下SO3的体积分数为91%,试回答下列问题:
(1)在生产中常采用过量的空气是为了________________________________;
(2)加热到400 ℃-500 ℃是由于___________________________________;
(3)压强应采用_________(填常压、加压、减压),原因是______________;
(4)常用浓硫酸来吸收SO3,而不用水,其原因是______________________;
(5)尾气中的SO2常用碱溶液吸收,是因为____________________________。
20.合成氨工业中,原料气(N2,H2及少量的CO,NH3的混合气),在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)2]Ac·CO+Q
(1)必须除去原料气中CO的原因是______________________。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件是_____________________。
(3)吸收CO后的醋酸二氨合铜(I)溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,醋酸二氨合铜(Ⅰ)溶液再生的条件是___________________。
19.紫色Cr2(SO4)3溶液中,加入NaOH到pH为4.6时溶液中有灰蓝色Cr(OH)3沉淀生成,Cr(OH)3在溶液中存在下列平衡:
 ?
?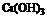 ?H
?H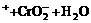
紫色 灰蓝色 绿色
将Cr(OH)3分成a、b两支试管,在a管中加NaOH溶液,b管中加入H2SO4溶液,其颜色变化:a中呈现____色,b中呈现_____色,原因是_________________________。
18.试用化学平衡的原理简要说明浓HNO3跟铜反应生成NO2,稀HNO3跟铜反应生成NO的原理____________________________。
17.某密闭容器中有如下可逆反应:A(气)+2B(气)?2C(气)+Q,达到平衡后,若改变反应条件将变化的情况填入空格:(填增大、减小、不变)
(1)升高温度,B的转化率_______,v(正)_______,v(逆)_________。
(2)加入催化剂,A的物质的量________,v(正)_______,v(逆)________。
(3)缩小容器的体积,则C的物质的量_______,A的转化率_______。
(4)若温度和体积不变,反应从A、B起达到平衡,在这个变化过程中,容器内的气体密度_______,压强_______。
16.甲、乙两瓶新制的氯水的浓度均为0.1 mol/L,如往甲瓶中加入适量的Na2CO3晶体,片刻后,甲、乙两瓶中HClO的物质的量浓度的关系是 。
A.甲>乙 B.乙>甲 C.甲=乙 D.无法确定
简述你选择的理由(用化学方程式和必要的文字说明)______________________。
15.已知工业上真空炼铷(Rb)的化学方程式为2RbCl+Mg MgCl2+2Rb,对此反应能够进行的正确解释为( )
MgCl2+2Rb,对此反应能够进行的正确解释为( )
A.高温下,Mg2+的电子能力比Rb+弱
B.MgCl2对热的稳定性比RbCl强
C.在一定条件下绝大多数反应都有可逆性
D.Rb的沸点比Mg低,抽走Rb蒸气,平衡向正反应方向移动
14.在密闭容器中发生反应a X(气)+b Y(气) ?c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的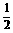 体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是( )
体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是( )
A.平衡向正反应方向移动
B.a+b>c+d
C.W的体积分数增大
D.X的转化率降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com