
题目列表(包括答案和解析)
1、化学键:在原子结合成分子时,相邻的原子之间强烈的相互作用,叫做化学键。化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
3、元素周期表与原子结构的关系
周期序数=电子层数 主族序数=最外层电子数=元素的最高正化合价数
主族元素的负化合价=8-主族序数
(6)A、B为短周期元素,A原子的原子核外共有7个电子,B原子M电子层的电子数为2,则A与B所形成的化合物的摩尔质量是( )
A. 62g/mol B. 95g/mol C. 100g/mol D. 148g/mol
(7)W、X、Y、Z都是短周期元素,其原子半径依次减小,它们的气态氢化物分子中具有相同的电子总数,Y元素原子的K层电子数与M层电子数之和等于L层电子数,则它们的最高价氧化物的分子式正确的是( )
A. WO B. X2O5 C. YO2 D. ZO3
(8)与Ne核外电子排布相同的阳离子跟与Ar核外电子排布相同的阴离子所组成的化合物是( )
A. KBr B. NaI C. CaF2 D. MgCl2
(9)关于元素周期表,下列说法正确的是( )
A.同周期元素,性质相似 B.元素按原子序数增大的顺序排列
C.元素按原子量从小到大的顺序排列 D.同主族元素核外电子层数相等
(10)下列各气态氢化物中,最不稳定的是( )
A. SiH4 B. PH3 C. H2S D. HCl
(11)X元素最高价氧化物的水化物分子式是H2XO3,它的气态氢化物的分子式为( )
A. HX B. H2X C. XH3 D. XH4
(12)某主族元素X原子的质量数为32,已知X离子,含有16个中子和18个电子,下列有关X元素的叙述错误的是( )
A. X元素属于ⅡA族
B. X在周期表里处于第三周期
C. X元素的最高价氧化物的水化物的分子式为H2XO4
D. X元素气态氢化物的分子式为H2X
(13)已知同周期的X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( )
A. 阴离子的还原性按X、Y、Z的顺序增强
B. 单质的氧化性按X、Y、Z的顺序减弱
C. 元素的非金属性按X、Y、Z的顺序增强
D. 气态氢化物的稳定性按X、Y、Z的顺序减弱
(14)氧化性由弱到强,原子或离子半径由大到小的一组微粒是( )
A. O、Cl、S、P B. Al3+、Mg2+、Ca2+、Ba2+
C. K+、Mg2+、Al3+、H+ D.
I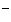 、Br
、Br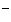 、Cl
、Cl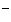 、F
、F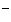
2、元素周期表
元素周期表是元素周期律的具体表现形式。
 短周期:第1-3周期
短周期:第1-3周期
|
不完全周期:第7周期
同周期元素性质递变规律:从左到右(稀有气体除外),元素的金属性逐渐减弱,非金属性逐渐增强。
 主族:ⅠA-ⅦA族
主族:ⅠA-ⅦA族
|
Ⅷ族:由3个纵行组成
0族:稀有气体元素
同主族元素性质递变规律:从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
1、元素周期律
元素的性质随着元素原子序数的递增而呈现周期性变化的规律,叫做元素周期律。
元素周期律主要体现在核外电子的周期性变化、原子半径的周期性变化和元素化合价、金属性及非金属性等的周期性变化方面。
元素性质的周期性变化:元素金属性的强弱,可以从它的单质跟水(或酸)反应置换出氢的难易程度,以及它的最高价氧化物的水化物--氢氧化物的碱性强弱来判断。元素非金属性的强弱,可以从它的最高价氧化物的水化物的酸性强弱,或跟氢气生成气态氢化物的难易程度以及氢化物的稳定性来判断。
元素性质周期性变化的实质是由于元素原子核外电子排布的周期性变化。
3、核外电子的排布
(1)核外电子运动的特征:电子在核外空间作高速运动,没有固定的轨道,好像带负电的云雾罩在原子核周围,人们现象地称之为电子云。
(2)电子层:根据电子的能量差别和通常运动的区域离核的远近不同,核外电子处于不同的电子层。
(3)电子排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(4)各电子层容纳的电子数:各电子层最多容纳的电子数是2n2个,最外层电子数不超过8个(K层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(5)电子层排布的表示方法:电子层排布可用原子结构示意图表示。
(1)原子核中一定含有( )
A. 质子 B. 中子 C. 电子 D. 质子和中子
(2)下列说法正确的是( )
A. 原子核都是由质子和中子构成的
B. 不同元素原子的质量数一定不等
C. 质子数决定元素的种类,质子数和中子数决定原子的种类
D. 质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同
(3)铜有两种天然同位素: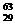 Cu,
Cu,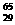 Cu,Cu的近似原子量为63.5,估计
Cu,Cu的近似原子量为63.5,估计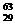 Cu的百分含量是( )
Cu的百分含量是( )
A. 20% B. 25% C. 50% D. 75%
(4)下列各组微粒:①O2和O3 ②H2和D2
③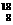 O和
O和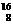 O ④1H218O和2H216O ⑤
O ④1H218O和2H216O ⑤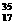 Cl和
Cl和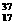 Cl,属同位素的是( )
Cl,属同位素的是( )
A. ①② B. ③⑤ C. ④ D. ②③
(5)核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中,所含质子的物质的量的( )
A. 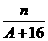 (A-N+8)mol
B.
(A-N+8)mol
B.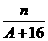 (A-N+10)mol
(A-N+10)mol
C.
(A-N+2)mol
D. 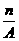 (A-N+6)mol
(A-N+6)mol
2、核素 同位素
具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同由元素的不同原子互称为同位素,也就是说,同一元素的不同核素之间互称为同位素。
1、构成原子的粒子间的关系如下:
 质子 Z个
质子 Z个
 原子核
原子核
原子 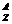 Z
中子 (A-Z)个
Z
中子 (A-Z)个
核外电子 Z个
质子数=核电荷数=核外电子数=原子序数
质量数=质子数+中子数
(1)在含有KCl、KI的混合液中,滴入足量的溴水,待反应完全后,将溶液蒸干,灼烧,最后得到的残留固体物质是( )
A. KCl和KBr B. KCl、KBr和I2 C. KBr D. KBr和KI
(2)实验室制备下列各组气体,所用气体发生装置基本相同的是( )
A. H2和O2 B.H2和HCl C.HCl和HF D.Cl2和HCl
(3)卤素原子结构有关数据,不符合F<Cl<Br<I的变化规律的是( )
A. 电子层数 B. 原子半径 C. 最外层电子数 D. 电子总数
(4)下列属于化学变化的是( )
A. 碘升华 B. 溴挥发
C. 氢氟酸刻玻璃 D. 用汽油从溴水中提取溴
(5)下列说法正确的是( )
A. 单质氯有气、固、液态三种状态 B. 氯气是黄绿色,所以氯化氢也是黄绿色
C. 液氯是氯气的水溶液 D. 氯气有毒,所以氯离子也有毒
(6)将盛满新制氯水的圆底烧瓶倒立于水槽中,被日光照射后,看到有气泡逸出,这气体是( )
A. O2 B. Cl2 C. HCl D. H2
(7)下列反应中,水作还原剂的是( )
A. 2Na+H2O==2NaOH+H2↑ B. 2F2+2H2O==4HF+O2↑
C. SO3+H2O==H2SO4 D. Cl2+H2O==HCl+HClO
(8)下列溶剂分别注入到少量碘水中振荡静置,溶液分层,下层显示紫色的是( )
A. 酒精 B. 苯 C. 汽油 D. 四氯化碳
(9)下列物质中不能使碘化钾淀粉试纸变蓝的是( )
A.氯水 B. 溴水 C. 碘水 D. 碘化钾溶液
(10)下列物质在氯气中燃烧后,生成物为混合物的是( )
A. Cu B. P C. H2 D. Na
(11)若除去Cl2中少量的HCl气体,可选用的试剂是( )
A. NaOH溶液 B. AgNO3溶液 C. 饱和食盐水 D. 饱和Na2CO3溶液
(12)在下列各组物质发生的化学反应中,氯元素部分被氧化,部分被还原的是( )
A. 氢气在氯气中燃烧 B. 氯气通入氢氧化钠溶液中
C. 二氧化锰与浓盐酸 D. 磷在氯气中燃烧
(13)下列物质的保存方法正确的是( )
A. 氢氟酸保存在塑料塞的玻璃瓶中
B. 液溴盛放在用橡皮塞的玻璃瓶中
C. 氯水贮于无色试剂瓶中,并密闭保存于阴凉处
D. 漂白粉密封保存于阴凉处
(14)随着核电荷数的递增,卤素性质的递变规律正确的是( )
①单质颜色逐渐加深 ②单质沸点升高 ③单质氧化性增强 ④离子半径逐渐增大 ⑤气态氢化物的稳定性逐渐增强 ⑥氢化物水溶液的酸性逐渐减弱
A. ①②③ B. ②④⑥ C. ①②④ D. ②③⑤⑥
(15)下列微粒化学性质最活泼的是( )
A. Cl2 B. Cl C. Cl- D. N2
(16)下列离子方程式书写正确的是( )
A. 金属Fe溶于稀盐酸:2Fe+6H+==2Fe3++3H2↑
B. 用NaOH对Cl2进行尾气吸收:Cl2+2OH-==Cl-+ClO-+H2O
C. Cl2溶于水:Cl2+H2O==2H++Cl-+ClO-
D. 碘化钾溶液中滴入溴水:Br2+I-==I+2Br-
(17)下列各组离子能在水溶液中大量共存的是( )
A. Ba2+、H+、Cl-、CO32- B. Ag+、NO3-、I-、K+
C. Na+、H+、K+、OH- D. Na+、Cl-、Fe3+、NO3-
第五章 物质结构 元素周期律
可逆反应 淀粉遇碘呈现出特殊的蓝色。碘的这一特性可以用来检验碘的存在。
含卤化合物的主要用途 (1)卤化银 (2)碘化合物的主要用途
(四)氯离子的检验 Cl-+Ag+==AgCl↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com