
题目列表(包括答案和解析)
(1)下列实验中,可以证明氯的非金属性比硫强的是( )
A. 单质分别与烧碱溶液反应 B. 氯气与硫化钠溶液反应
C. 比较NaClO3与Na2SO3的溶解性 D. 比较两单质的状态
(2)实验室可用浓硫酸制取的气体是( )
A. HF和HCl B. HF和HI C. HCl和HI D. HI和HBr
(3)常温下能用铁容器盛放的物质是( )
A. 硫酸铜溶液 B. 浓盐酸 C. 浓硫酸 D. 稀硫酸
(4)下列气体分别通入H2S的水溶液,不会因发生化学反应使溶液变混浊的是( )
A. 空气 B. 氯化氢 C. 二氧化硫 D. 氯气
(5)部分氧族元素形成的氢化物的稳定性及含氧酸的酸性由大到小的顺序都正确的是( )
A. H2S>H2Se和H2SO4>H2TeO4 B. H2Te>H2S和H2SeO4>H2TeO4
C. H2Se>H2Te和H2SeO4>H2SO4 D. H2Se>H2S和H2SO4>H2TeO4
(6)用0.1mol/L的Na2SO3溶液30mL,恰好将2×10-3molXO4-离子还原,则元素X在还原产物中的化合价是( )
A. +1 B. +2 C. +3 D. +4
(7)下列各组离子可以在溶液中大量共存的是( )
A. Fe3+,Na+,SO42-,OH- B. Cu2+,H+,S2-,Cl-
C. Na+,K+,Cl-,SO42- D. Ba2+,K+,CO32-,OH-
(8)下列反应不能用离子方程式:Ba2++SO42-==BaSO4↓表示的是( )
A. Ba(NO3)2+K2SO4==BaSO4↓+2KNO3 B. BaCl2+K2SO4==BaSO4↓+2KCl
C. Ba(OH)2+K2SO4==BaSO4↓+2KOH D. Ba(OH)2+H2SO4==BaSO4↓+2H2O
(9)下列气体中既不能用浓硫酸,又不能用氢氧化钠干燥的是( )
A.氨 B. 硫化氢 C. 二氧化硫 D. 氢气
(10)以下每组有两个化学反应,这两个化学反应只放出同一种气体物质是( )
A. Zn和稀H2SO4,Zn与浓H2SO4 B. Cu与浓H2SO4,Fe与稀H2SO4
C. Na2S与稀H2SO4,Na2S与稀盐酸 D. C与浓H2SO4,C与浓HNO3
(11)区别CO2和SO2的最佳方法是( )
A. 用湿润的蓝色石蕊试纸 B. 通过澄清石灰水
C. 用品红溶液 D. 通过硫酸铜溶液
(12)为鉴别MgCO3、BaCO3、BaCl2、Na2SO4四种固体,可从下列各组试剂中选用的最佳一组是( )
A. 水和盐酸 B. 水和稀硫酸 C. 水和硝酸 D. 水和NaOH溶液
(13)下列有关NaHS的说法不正确的是( )
A. NaHS的电离方程式是:NaHS==Na++H++S2- B. NaHS能与盐酸反应
C. NaHS能与碱溶液反应 D. NaHS溶液能与SO2反应
(14)在常温、常压下混有a LH2S气体和b LSO2气体,充分反应后混合气体体积缩小到原来的一半,则a:b可能是( )
A. 2:1 B. 3:1 C. 4:1 D. 5:1
(15)标准状态下,均为5.6L的SO2和O2混合,在一定条件下反应,得到(标准状态下)混合气体10.06L,则剩余SO2的体积为( )
A. 1.12L B. 2.4L C. 4.84L D. 5.4L
(16)下列变化各根据硫酸的什么性质?
①铜与浓硫酸加热制二氧化硫: ②固体食盐与浓硫酸反应制HCl:
③锌与稀硫酸反应制氢气: ④浓硫酸滴在木板上,使木板变黑:
⑤浓硫酸干燥氯气:
第七章 硅和硅酸盐工业
碳族元素位于周期表的第ⅥA族,随着核电荷数的增加,它们的性质呈规律性变化。
C Si Ge Sn Pb
 非金属性减弱,金属性增强
非金属性减弱,金属性增强
(二)硫酸根离子的检验
先用盐酸或稀硝酸把溶液酸化,以排除CO32-等可能造成的干扰。再加入BaCl2溶液或Ba(NO3)2溶液,如果有白色沉淀出现,则说明原溶液中有SO42-存在。
(一)硫酸
纯硫酸是一种无色油状液体。硫酸是一种难挥发的强酸,易溶于水,能以任意比与水混溶。浓硫酸溶解时放出大量的热。
浓硫酸有强烈的吸水性、脱水性和氧化性。
2H2SO4(浓)+Cu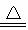 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
2H2SO4(浓)+C CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
在常温下浓硫酸能使铁、铝等金属钝化。但在受热情况下,浓硫酸不仅能跟铁、铝等起反应,还能跟绝大多数金属起反应。
(二)二氧化硫的污染
二氧化硫是污染大气的主要有害物质之一。空气中的二氧化硫在氧气和水的共同作用下,会形成酸雾。空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨。正常雨水的pH约为5.6(溶解了二氧化碳的原因),酸雨的pH小于5.6。
空气中的二氧化硫主要来自化石燃料的燃烧,以及含硫矿石的冶炼和硫酸、磷肥、纸浆生产等产生的工业废气。因此,这些废气必须经过处理后才能向大气中排放。
(一)二氧化硫的性质
二氧化硫是一种无色、有刺激性气味的有毒气体。它的密度比空气大,易液化,易溶于水。在常温、常压下,1体积水大约能溶解40体积二氧化硫。
|
 1、与水的反应:SO2+H2O H2SO3
1、与水的反应:SO2+H2O H2SO3

 H2O+SO2↑
H2O+SO2↑
2、与氧气反应
在二氧化硫中,硫的化合价是+4价,因此,二氧化硫既具有一定的氧化性,又具有一定的还原性。
2SO2+O2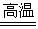 2SO3,SO3是一种无色固体,熔点和沸点都较低。SO3与H2O反应生成H2SO4,同时放出大量的热。SO3+H2O==H2SO4
2SO3,SO3是一种无色固体,熔点和沸点都较低。SO3与H2O反应生成H2SO4,同时放出大量的热。SO3+H2O==H2SO4
在工业生成上,常利用上面两个反应制造硫酸。
3、漂白性 原理:二氧化硫跟某些有色物质结合生成不稳定的无色物质。
2、臭氧 3、过氧化氢(H2O2)
1、同素异形体
由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。如:O2和O3,金刚石和石墨,硫也有多种同素异形体。
氧族元素都具有一定的氧化性,其中氧的氧化性最强,硫、硒、碲随着原子半径的增大,氧化性逐渐减弱。
|
化学式 |
O2 |
S |
Se |
Te |
|
|
物理性质 |
颜色 |
无色 |
黄色 |
灰色 |
银白色 |
|
状态 |
气体 |
固体 |
固体 |
固体 |
|
|
密度 |
1.43g/L |
2.07g/cm3 |
4.81g/cm3 |
6.26g/cm3 |
|
|
熔、沸点 变化 |
 逐渐升高 逐渐升高 |
||||
|
化学性质 |
氢化物的化学式及稳定性 |
H2O |
H2S |
H2Se |
H2Te |
|
稳定 |
不稳定 |
不稳定 |
不稳定 |
||
|
常见氧化物的化学式 |
- |
SO2 SO3 |
SeO2 SeO3 |
TeO2 TeO3 |
|
|
最高价氧化物水合物的化学式 |
- |
H2SO4 |
H2SeO4 |
H2TeO4 |
氧族元素原子的电子层结构很相似,它们原子的最外层都有6个电子。氧族元素随着核电荷数的增加,电子层数增多,原子半径逐渐增大。
2、离子键和共价键
 离子键
离子键
 化学键 非极性键
化学键 非极性键
共价键
极性键
(1)离子键:使阴、阳离子结合成化合物的静电作用。
(2)共价键:原子之间通过共用电子对所形成的相互作用。
①非极性键:同种原子形成共价键,共用电子对不偏向任何一个原子。
②极性键:不同种原子形成共价键,共用电子对偏向吸引电子能力强的一方。
(15)下列变化中,不需要破坏化学键的是( )
A. 金属钠的熔化 B. 硝酸钾溶于水 C. 干冰气化 D. 电解水
(16)下列分子中具有极性键的非极性分子是( )
A. H2S B. CS2 C. SO2 D. H2
(17)共价键不可能出现在( )
A. 单质中 B. 离子化合物中 C. 金属中 D. 结晶水合物中
第六章 硫和硫的化合物 环境保护
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com