
题目列表(包括答案和解析)
化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的动态平衡,可以从正反应达到,也可以从逆反应达到。在平衡状态时,平衡混合物里各组分的浓度保持不变。当浓度、温度等条件改变时,化学平衡即被破坏,并将在新的条件下建立新的平衡状态,这就是化学平衡的移动。
影响化学平衡的条件:
1、浓度 在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
化学反应速率是用来衡量化学反应进行的快慢的,用单位时间里反应物浓度的减少或生成物浓度的增加来表示,单位常用mol/(L·s)或mol/(L·min)。参加化学反应的物质的性质是决定化学反应速率的主要因素,不同的物质参加的化学反应,具有不同的反应速率。此外,温度、浓度、压强和催化剂等也能影响化学反应速率。
(1)下列关于化学反应速率的说法中,正确的是( )
A. 化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B. 化学反应速率为1.0mol/(L·s)是指1s时某物质的浓度为1.0mol/L
C. 根据化学反应速率的大小,可以判断反应进行的快慢
D. 对于任何化学反应来说,反应速率越大,反应现象就越明显
(2)在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内v(H2)为0.45mol/(L·s),则所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内v(H2)为0.45mol/(L·s),则所经过的时间是( )
A. 0.44s B. 1s C. 1.33s D. 2s
(3)反应4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后NO的物质的量增加了0.3mol,则此反应的平均速率为( )
4NO+6H2O在550℃的5L密闭容器中进行,0.5min后NO的物质的量增加了0.3mol,则此反应的平均速率为( )
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.008mol/(L·s)
C. v(H2O)=0.003mol/(L·s) D. v(NH3)=0.004mol/(L·s)
纯硝酸是无色、易挥发、有刺激性气味的液体。
硝酸是一种强酸,具有酸的通性,能与碱及碱性氧化物等反应生成硝酸盐和水。此外,硝酸还具有本身的特性。
硝酸的不稳定性 4HNO3 2H2O+4NO↑+CO2↑
2H2O+4NO↑+CO2↑
硝酸的氧化性
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)==Cu(NO3)2+2NO↑+4H2O
硝酸是一种强氧化剂,几乎能与所有的金属(除金、铂等少数金属外)发生氧化还原反应。铁、铝等金属在冷的浓硝酸中会发生钝化现象。硝酸还能与许多非金属及某些有机物发生氧化还原反应。
4HNO3+C==2H2O+4NO2↑+CO2↑
万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打水或肥皂洗涤。
浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
(1)下列氢化物中,最不稳定的是( )
A. HCl B. NH3 C. PH3 D. HF
(2)对14N和15N来说,不相同的是( )
A.质子数 B. 中子数 C. 核电荷数 D. 核外电子数
(3)下列关于氮的叙述中不正确的是( )
A. 氮分子为非极性分子 B. 氮气的性质活泼,在常温下能与H2、O2等非金属反应
C. 液氮可做制冷剂 D. 氮有多种化合价
(4)在NO2与水的反应中,NO2( )
A. 只是氧化剂 B. 只是还原剂
C. 既是氧化剂又是还原剂 D. 既不是氧化剂又不是还原剂
(5)下列元素的原子半径最大的是( )
A. 氮 B. 氧 C. 硫 D. 磷
(6)下列关于氨的叙述中,不正确的是( )
A. 可作制冷剂 B. 在某些反应中具有还原性
C. 氨分子是非极性分子 D. 氨气是一种有刺激性气味,易液化的气体
(7)下列气体中,不会造成空气污染的是( )
A. N2 B. NO C. NO2 D. CO
(8)下列气体中,不能用排空气法收集的是( )
A. CO2 B. H2 C. NO2 D. NO
(9)下列物质中酸性最强的是( )
A. H3PO4 B. HNO3 C. H2CO3 D. H3BO3
(10)实验室制取下列气体时,与实验室制氨气的发生装置相同的是( )
A. H2 B. O2 C. Cl2 D. CO2
(11)通常状况下能共存,且能用浓硫酸干燥的一组气体是( )
A.H2、O2、N2 B.O2、NO、NO2
C.H2、N2、NH3 D.NH3、HCl、NO2
(12)只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )
A. NaOH溶液 B. AgNO3溶液 C. BaCl2溶液 D. Ba(OH)2溶液
(13)试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
A. 加水,将湿润的红色石蕊试纸放在试管口
B. 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C. 加氢氧化钠溶液,加热,滴入酚酞试剂
D. 加氢氧化钠溶液,加热,滴入紫色石蕊试剂
(14)常温下能用铝制容器盛放的是( )
A. 浓盐酸 B. 浓硝酸 C. 稀硝酸 D. 稀硫酸
(15)硝酸应避光保存是因为它具有( )
A. 强酸性 B. 强氧化性 C. 挥发性 D. 不稳定性
(16)加热下列物质,发生氧化还原反应的是( )
A. NH4Cl B. NH4HCO3 C. 浓盐酸 D. 浓硝酸
(17)下列关于硝酸的叙述正确的是( )
A. 稀硝酸的弱酸,浓硝酸是强酸
B. 铜与浓硝酸和稀硝酸都能反应生成二氧化氮
C. 浓硝酸和稀硝酸都是强氧化剂
D. 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
(18)下列物质中,既能与氨反应,又能与二氧化碳反应的是( )
A. 氢氧化钠 B. 氯化氢 C. 氧气 D. 水
第九章 化学平衡 电离平衡
铵盐都是晶体,并且都能溶于水。
铵盐受热分解
NH4Cl NH3↑+HCl↑
NH3+HCl==NH4Cl(假升华)
NH3↑+HCl↑
NH3+HCl==NH4Cl(假升华)
NH4HCO3 NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
铵盐与碱反应 (NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
铵盐与碱共热都产生氨气,这是铵盐的共同性质。利用此反应,可检验铵离子的存在,可用于实验室制取氨气。
氨的实验室制法:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
固体和固体加热制取氨气,用向下排空气法收集气体,用湿润的红色石蕊试纸或用玻璃棒蘸取浓盐酸验满,用碱液吸收氨气以防止污染空气。
氨是无色、有刺激性气味的气体,密度比空气小。氨易液化,液氨常用作制冷剂。
氨的化学式是NH3,氨分子的结构呈三角锥型,是极性分子。
氨与水反应
氨极易溶于水,氨的水溶液叫做氨水。氨水显弱碱性。

 NH3+H2O NH3·H2O NH4++OH-
NH3+H2O NH3·H2O NH4++OH-
NH3·H2O不稳定,受热时分解为NH3和H2O。
NH3·H2O NH3↑+H2O
NH3↑+H2O
氨与氯化氢的反应 NH3+HCl==NH4Cl
氨与氧气反应(氨的催化氧化,是工业上制硝酸的基础)
 4NH3+5O2 4NO+6H2O
4NH3+5O2 4NO+6H2O
2、与氧气反应
N2+O2 2NO(无色、不溶于水的气体) NO+O2==2NO2(红棕色、有刺激性气味的有毒气体)
2NO(无色、不溶于水的气体) NO+O2==2NO2(红棕色、有刺激性气味的有毒气体)
3NO2+H2O==2HNO3+NO(工业制取硝酸)
纯净的氮气是一种无色的气体,密度比空气的稍小。氮气在水中的溶解度很小。
氮气是具有N≡N键的双原子分子,结构稳定,化学性质不活泼,但在一定条件下能跟某些物质反应。
1、 与氢气反应
与氢气反应
N2+3H2 2NH3
硅酸盐材料:水泥、玻璃、陶瓷等
新型无机非金属材料:高温结构陶瓷、光导纤维等
(1)不能通过化合反应来制取的物质是( )
A. H2SiO3 B. Na2O2 C. SiO2 D. CaSiO3
(2)有关碳族元素的说法中,不正确的是( )
A. 随着原子序数的增大,单质熔沸点逐渐降低 B. 均以+4价为稳定化合价态
C. 碳族元素形成的化合物种类最多 D. 锗元素的金属性比非金属性强
(3)下列说法不正确的是( )
A. 常温下,硅和强碱溶液可以发生化学反应 B. 高温下,硅与氢氟酸才能发生反应
C. 地壳中硅元素的含量占第二位 D. 水晶是石英晶体
(4)下列叙述不正确的是( )
A. 普通玻璃无固定的熔点,只能在一定的范围内软化
B. 硅藻土可做催化剂的载体和吸附剂
C. 水泥、沙子和水的混合物叫做沙浆
D. SiO2与Na2CO3固体在高温下也可共存
(5)鉴别Na2CO3和Na2SiO3两种溶液的试剂(方法)可选用( )
A.焰色反应 B. 盐酸 C. 石灰水 D. 氯化钙溶液
(6)下列物质主要成分不属于硅酸盐的是( )
A. 粘土 B. 石膏 C. 水玻璃 D. 水泥
(7)要除去二氧化碳气体中混有的氯化氢气体,可将气体通过哪种饱和溶液( )
A. NaHCO3 B. Na2CO3 C. Na2SiO3 D. NaOH
(8)在下列溶液中通入过量的CO2,但仍能产生沉淀的是( )
A. 漂白粉 B. 氯化钙溶液 C. 石灰水 D. 水玻璃
(9)下列说法正确的是( )
A. 二氧化硅分子是由一个硅原子和二个氧原子组成的
B. 水玻璃应贮存在带玻璃塞的玻璃瓶中
C. SiO2是酸性氧化物,可与水生成硅酸
D. 原硅酸失水生成硅酸,硅酸再失水生成硅酸酐
(10)工业制取下列产品,其原料肯定不需要石灰石的是( )
A. 石灰 B. 单晶硅 C. 水泥 D. 玻璃
第八章 氮和氮的化合物
氮族元素位于元素周期表的第ⅤA族,随着核电荷数的增加,它们的性质呈现规律性变化。
 得电子能力减弱,失电子能力增强
得电子能力减弱,失电子能力增强
N P As Sb Bi
非金属性减弱,金属性增强
|
SiO2+CaO==CaSiO3 SiO2+2NaOH==Na2SiO3+H2O
二氧化硅是酸性氧化物,它对应的水化物的硅酸(H2SiO3)。硅酸不溶于水,是一种弱酸,它的酸性比碳酸还要弱。
在硅的化合物中,还有一类是硅酸盐。硅酸盐种类很多,结构也很复杂,通常可用二氧化硅和金属氧化物的形式来表示其组成。例如:
硅酸钠 Na2SiO3 (Na2O·SiO2)
高岭石 Al2(Si2O5)(OH)4 (Al2O3·2SiO2·2H2O)
在地壳中,硅的含量仅次于氧,居第二位。在自然界中,只有以化合态存在的硅,如二氧化硅、硅酸盐等。这些化合态的硅广泛存在于地壳的各种矿物和岩石里,是构成矿物和岩石的主要成分。
硅有晶体硅和无定形硅两种同素异形体。晶体硅结构类似于金刚石,熔点和沸点都很高,硬度也很大。晶体硅还是良好的半导体材料。
在常温下,硅的化学性质不活泼,除氟气、氢氟酸和强碱外,硅不跟其他物质起反应。在加热条件下,硅能跟一些非金属反应。
Si+O2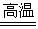 SiO2
SiO2
在工业上,用碳在高温下还原二氧化硅的方法可制得含有少量杂质的粗硅。
SiO2+2C Si+2CO↑
Si+2CO↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com