
题目列表(包括答案和解析)
4、在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是
A.纯碱 B.石灰石 C.石英 D.粘土
3、不能由单质直接与O2反应生成的氧化物是
A.NO2 B.SO2 C.P2O5 D.Al2O3
2、下列互为同位素的是
A.金刚石和石墨 B.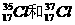 C.乙烷和丙烷 D.T2O和D2O
C.乙烷和丙烷 D.T2O和D2O
1、污染大气并形成酸雨的主要物质是
A.CO B.NH3 C.SO2 D.HCl
用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
如果用A代表一元强酸,用B代表一元强碱,则cB==cAVA/VB。
(16)酸和碱恰好完全中和时,它们起反应的( )一定相等。
A. 质量 B. 物质的量 C. 物质的量浓度 D. H+和OH-的物质的量
(17)物质的量浓度相同的一元强酸和一元强碱相互反应时,溶液( )
A. 呈酸性 B. 呈碱性 C. 呈中性 D. 酸碱性无法判断
2、盐类的水解
盐类的离子与水电离出来的H+或OH-相结合生成弱电解质的反应,叫做盐类的水解反应。水解反应是中和反应的逆反应。
例如:强碱弱酸盐的水解,溶液呈碱性:
CH3COONa CH3COONa+H2O
CH3COONa+H2O
CH3COOH+NaOH或CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
Na2CO3
 CO32-+H2O
CO32-+H2O HCO3-+OH- HCO32-+H2O
HCO3-+OH- HCO32-+H2O H2CO3+OH-
H2CO3+OH-
(多元弱酸根离子分步水解,以第一步为主)
强酸弱碱盐的水解,溶液呈酸性
NH4Cl
NH4++H2O NH3·H2O+H+
NH3·H2O+H+
Al2(SO4)3 Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
规律:谁弱谁水解,无弱不水解,谁强显谁性,同强显中性。
(12)甲溶液的pH为4,乙溶液的pH为2,甲溶液与乙溶液的c(H+)之比是( )
A. 100 B. 1/100 C. 2 D. 1/2
(13)在CH3COOH溶液中存在下列平衡:CH3COOH CH3COO-+H+,欲使平衡向分子化方向移动,应加入的物质是( )
CH3COO-+H+,欲使平衡向分子化方向移动,应加入的物质是( )
A. H2O B. NaOH C. NaClO D. HCl
(14)下列溶液中,因水解反应而呈碱性的是( )
A. KOH B. Na2SO4 C. NH4Cl D. K2S
(15)在Na2S溶液中,c(Na+)与c(S2-)的关系是( )
A. c(Na+)= c(S2-) B. c(Na+):c(S2-)=2:1
C. c(Na+):c(S2-)>2:1 D. c(Na+):c(S2-)<2:1
1、水的电离
水是极弱的电解质,能微弱地电离出H+和OH-,在25℃时,水中c(H+)和c(OH-)的乘积为1×10-14。
当c(H+)>1×10-7mol/L时,其pH<7,溶液呈酸性;当c(H+)=1×10-7mol/L时,其Ph=7,溶液呈中性;
当c(H+)<1×10-7mol/L时,其Ph>7,溶液呈碱性;
强酸、强碱和大多数盐类属于强电解质,强电解质在水溶液里全部电离。弱酸、弱碱等属于弱电解质。弱电解质的电离是一个可逆过程,溶液中未电离的电解质分子和已电离的离子处于平衡状态,如CH3COOH溶液、氨水中的电离:CH3COOH H++CH3COO- NH3·H2O
H++CH3COO- NH3·H2O NH4++OH-
NH4++OH-
这种在一定条件下,电解质分子电离成离子的速率和离子重新结合成分子的速率相等时的状态,叫做电离平衡。
电离平衡是动态平衡,当浓度、温度等条件发生改变时,平衡就向能够减弱这种变化的方向移动。
(8)下列各组物质中,都属于电解质的是( )
A. 食盐、氢氧化钾、二氧化碳 B. 铁、氢氧化钠、硫酸钾
C. 氯化铵、酒精、烧碱 D. 氯化铜、一水合氨、无水硫酸
(9)下列对于电解质的描述中,正确的是( )
A. 凡能导电的物质就是电解质 B. 电解质一定要在溶液中才能导电
C. 电解质有强电解质和弱电解质之分,只有弱电解质才存在电离平衡状态
D. 电解质一定是无机化合物
(10)下列电离方程式正确的是( )
A. H2S==2H++S2- B. NH3·H2O==NH4++OH-
C. Al(OH)3==Al3++3OH- D. FeCl3==Fe3++3Cl-
(11)下列离子方程式中,能正确反映CH3COOH与NaOH反应的是( )
A. CH3COOH+OH-==CH3COO-+H2O B. H++OH-==H2O
C. CH3COOH+Na++OH-==CH3COONa+H2O
D. CH3COO-+H++OH-==CH3COO-+H2O
3、温度 在其他条件不变的情况下,温度升高,会使化学平衡向着吸热反应的方向移动;温度降低,会使化学平衡向着放热反应的方向移动。
浓度、压强、温度对化学平衡的影响可以概括为平衡移动原理,也叫勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动。
催化剂不能改变达到平衡状态的反应混合物的组成,但是使用催化剂,能够改变反应达到平衡所需的时间。
(4)在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中正确的是( )
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应的进行,正反应速率逐渐减小,最后为零
C. 随着反应的进行,逆反应速率逐渐最大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
(5)一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡状态的标志是(
)
2C(g)达到平衡状态的标志是(
)
A. 物质C的生成速率与物质C的分解速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. A、B、C三物质的分子个数比为1:3:2
D. 单位时间生成nmolC,同时生成nmolA
(6)在一个恒容的密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO2(g),已知反应过程中某一深刻SO2、SO3、O2的浓度分别为0.2mol/L、0.2mol/L、0.1mol/L,当反应达到平衡时下列数据可能的是( )
2SO2(g),已知反应过程中某一深刻SO2、SO3、O2的浓度分别为0.2mol/L、0.2mol/L、0.1mol/L,当反应达到平衡时下列数据可能的是( )
A. c(SO2)=0.4mol/L B. c(SO2)=0.25mol/L
C. c(SO2)=c(SO3)=0.15mol/L D. c(SO3)=0.4mol/L
(7)已知下列反应中的X、Y、Z都是气体,在减压或升温后Z的含量都升高的是( )
A. X+Y 3Z(正反应为放热反应) B. 2X+Y
3Z(正反应为放热反应) B. 2X+Y 2Z(正反应为吸热反应)
2Z(正反应为吸热反应)
C. X+2Y 4Z(正反应为吸热反应) D. X+Y
4Z(正反应为吸热反应) D. X+Y 2Z(正反应为吸热反应)
2Z(正反应为吸热反应)
2、压强 对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使化学平衡向着气体体积增大的方向移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com