
题目列表(包括答案和解析)
1.(1)某学生将书写化学方程式的步骤概括为“一写、二配、三注”。下面是书写“镁带燃烧”化学方程式的过程,你认为各步书写是否正确?如不正确请说明原因。
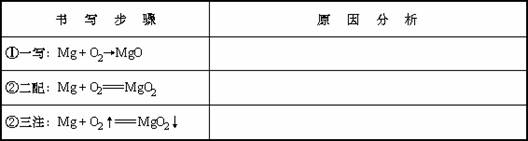
(2)请按上述书写步骤正确书写两个化学方程式。
①细铁丝在氧气中燃烧 ②(自编题)
一写 二配 三注
20.把15g大理石高温加热直至没有气体放出,并依次如表5-3实验,称其剩余固体的质量(杂
质不反应不挥发),有关结果记录如表5-3.
表5-3
|
通入紫色石蕊试液 |
通入澄清石灰水 |
称量剩余物 |
|
溶液变为红色 |
石灰水变浑浊,物质总质量增加4.4g |
剩余固体重9.06g |
(1)什么物质使紫色石蕊变红?写出有关化学方程式.___________________________________
(2)求大理石中碳酸钙的质量分数.
答案:(1)碳酸使之变红 CO2+ H2O= H2CO3
(2)设大理石中碳酸钙的质量分数为x
mCO2=15 g-9.06 g=5.94 g
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
15 g·x 5.94 g
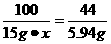
x=90%
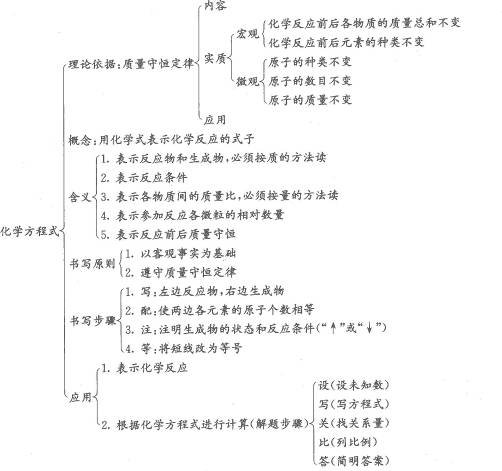
第5单元知识网络
19.为了测定炭粉与氧化铜的混合物中氧化铜的含量,甲、乙、丙、丁四位同学用该样品进行实验,测得的实验数据如表5-2.
(1)混合物中氧化铜的质量分数是________________________.
(2)四位同学中所取稀硫酸不足的是________________________.
(3)求硫酸溶液中的溶质的质量分数________________________.
表5-2
|
物质质量 |
甲 |
乙 |
丙 |
丁 |
|
所取混合样品/g |
25 |
25 |
20 |
20 |
|
加入稀硫酸/g |
50 |
100 |
100 |
120 |
|
反应后剩余固体/g |
21 |
17 |
12 |
12 |
答案:(1)40% 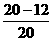 ×100%=40%.
×100%=40%.
(2)甲、乙
(3)9.8%
设硫酸溶液中溶质的质量分数为x
CuO+ H2SO4====CuSO4+ H2O
80 98
8 g 100 g·x
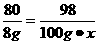
x=9.8%
知识积累
18.把干燥、纯净的高锰酸钾和氯酸钾的混合物27 g装入大试管中加热制取氧气.当反应不再产生气体为止,待试管冷却后加入定量的水,溶解、过滤.滤出不溶物干燥后称重,质量为4.35g,求原混合物中氯酸钾的质量分数,生成氧气在标准状况下的体积是多少升?(标准状况下氧气密度为1.429 g/L)
提示:当反应不再产生气体时,意味着KMnO4和KClO3已完全分解.反应后的不溶物经处理后称质量为4.35 g,实际上是分解产生的MnO2的质量.由此可求出KMnO4及其产生氧气的质量.由高锰酸钾的质量可求KClO3的质量.由KClO3的质量可求其分解产生的氧气的质量.KMnO4和KClO3分解产生的氧气的质量之和为反应生成氧气的总质量.由氧气的质量及密度可求氧气的体积.
中考链接
17.将6g镁分别与不同质量的氧气反应.试将表5-1中生成氧化镁的质量填入表5-1并回答:
表5-1
|
氧气的质量/g |
生成氧化镁的质量/g |
|
2 |
|
|
4 |
|
|
8 |
|
|
12 |
|
(1)当第一次与2g氧气反应时,为什么不能生成8gMgO?
(2)从第二次以后,为什么不断增加氧气的质量,生成氧化镁的质量却不增加?
答案:当两种物质发生化学反应时,是按一定质量比进行的,所以在进行化学计算时一定要注意所给的物质是否参加了化学反应,有多少反应了.
(1)因为这时有3g镁剩余未参加反应.
(2)因为从第2次起实际参加反应的氧气只有4g,所以氧气有剩余.
表D5-1
|
氧气的质量/g |
生成氧化镁的质量/g |
|
2 |
5 |
|
4 |
10 |
|
8 |
10 |
|
12 |
12 |
16.黑火药是我国古代四大发明之一,它是由木炭、硫磺、火硝(硝酸钾)按一定比例混合而成,爆炸时生成硫化钾、氮气和二氧化碳.黑火药爆炸的化学方程式是__________________________.
答案:3C+S+2KNO3 K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
15.用KMnO4制8gO2,反应完全后的混合物中氧化物的质量分数_____________.
答案:30.6%
注意分解完后的生成物中只有MnO2为氧化物,而O2为气体,所以反应后的混合物为K MnO2和MnO2.两者质量之比为一定值.
MnO2和MnO2.两者质量之比为一定值.
14.加热9.48g高锰酸钾放出的氧气与__________氯酸钾受热完全分解放出氧气的质量相等.
答案:2.45 g
13.下列混合物,无论以何种比例混合,只要完全燃烧后生成的CO2和H2O的分子个数比均为常数的是 ( )
A.C2H2和C6H6 B.C3H6和C3H8 C.CH4和C3H8 D.C2H4和C4H8
答案:AD
12.某有机物在氧气中完全燃烧,生成CO2和H2O的质量比是22:9.则该有机物可能是 ( )
A.C6H12O6 B.C3H6 C.C2 H2 D.C2H5OH
答案:ABD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com