
题目列表(包括答案和解析)
2.反应N2+O2 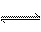 2NO 在密闭容器中进行,下列不能加快反应速率的条件是
2NO 在密闭容器中进行,下列不能加快反应速率的条件是
A. 缩小体积,增大压强
B.体积不变,充入N2使压强增大
C. 体积不变,充入氦气使压强增大
D.体积不变,充入NO使压强增大
1.下列说法不正确的是
A.焓变是一个反应能否自发进行的相关因素,多数放热反应能自发进行
B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.能自发进行的反应一定能迅速进行
D.一个反应能否自发进行,与焓变和熵变的共同影响有关
28.将一定量的镁铝合金投入100mL一定浓度的盐酸中,合金全部溶解,向所
 得溶液中滴加5mol/L的氢氧化钠溶液体积的关系如下图所示:
得溶液中滴加5mol/L的氢氧化钠溶液体积的关系如下图所示:
由图中数值计算:
(1)合金中镁的质量分数;
(2)合金中镁、铝物质的量之比;
(3)所用盐酸的物质的量浓度。
27.(14分)(1)在酸碱中和滴定实验中,在中和滴定之前盛标准液的滴定管有如下几步操作:①润洗 ②洗涤 ③调液面 ④读数 ⑤注液
合理顺序是
(2)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列实验操作会引起测量结果偏高的是 。(填代号)
A.用天平称量NaOH固体,将试剂放在右盘,砝码放在左盘,并移动游码便之平衡;
B.配制烧碱溶液时,将称量后的NaOH固体溶于水后,立即移入容量瓶并将洗涤液也转入容量瓶,再加蒸馏水到刻度线
C.中和滴定时,锥形瓶内有少量水
 D.酸式滴定管用蒸馏水洗后,未用标准溶液洗
D.酸式滴定管用蒸馏水洗后,未用标准溶液洗
E.读取滴定终点时,仰视刻度线
(3)右图为10ml一定物质的量浓度的盐酸X用一定浓度的NaOH溶液Y滴定的图示,依据图示和表中的数据
推出X和Y的物质的量浓度可能是( )
|
|
A |
B |
C |
D |
|
X物质的量浓度 (mol·L-1) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y物 质的量浓度 (mol·L-1) |
0.04 |
0.12 |
0.09 |
0.03 |
(4)常温下用0.05 mol·L-1盐酸测定某知浓度的Ba(OH)2溶液,实验数据如下表所示
|
实验编号 |
待测Ba(OH)2溶液的体积(ml) |
滴入0.05mol·L-1HCl体积(ml) |
|
1 |
10.00 |
20.02 |
|
2 |
10.00 |
19.98 |
|
3 |
10.00 |
20.00 |
则Ba(OH)2溶液的pH为 .
26.(6分)下面a-e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
(1)其中标出仪器使用温度的是 (填写编号);
(2)能够用以精确量取液体体积的是 (填写编号);
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 。
25.(8分)从铁、铝合金出发的反应如图:
试确定A,C,G,的化学式:
A________________, C____________,
G________________,
写出C气体和Cl2反应的化学方程_________________________________________
24、(本题8分)某化工厂生产中要用到一种无色、可溶于水的晶体--铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵--NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:①溶液中出现白色沉淀,白色沉淀量逐渐增多 ②有刺激性气味的气体放出 ③白色沉淀量逐渐减少,白色沉淀完全消失,请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
①
②
③
23、(本题8分)在密闭容器中的可逆反应CO(g)+NO2(g) 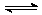 CO2(g)+NO(g);正反应是放热反应,达到平衡后:
CO2(g)+NO(g);正反应是放热反应,达到平衡后:
(1)扩大容器体积,平衡______,(填“变大” “变小”或“不变” )反应混合物的颜色变______。(填“深”“浅)
(2)升高温度平衡______。(填“向左”“向右” 或“不” )
(3)加入催化剂,NO的物质的量______。(填“变大” “变小”或“不变” )
22.在一个密闭容器中,充入3 mol A和1 mol B,发生如下反应:
3A(g)+B(g) 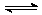 2C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器的压强和温度不变,按下列四种方法改变起始物质的用量,达到平衡后,C的浓度仍为W mol·L-1的是:
2C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器的压强和温度不变,按下列四种方法改变起始物质的用量,达到平衡后,C的浓度仍为W mol·L-1的是:
①1 mol B+2 mol C+1 mol D ②3 mol A+1 mol B+2 mol C
③6 mol A+2 mol B ④2 mol C+1 mol D
A.①② B.③④ C.②③ D.只有④
21.常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(CH3COO-)<c(Na+) B.c(CH3 COO-)>c(Na+)
C.c(CH3COO-)=c(Na+) D.无法确定c(CH3 COO-)与c(Na+)的关系
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com