
题目列表(包括答案和解析)
13.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2
是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之
溶解。欲除去溶液中的杂质离子,下述方法正确的是 ( )
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀 C.直接加水加热使杂质离子水解除去 D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
12.下列关于杂化轨道的叙述中,不正确的是 ( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子
C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
11.据报道,科学家最近确认世界上还存在着另一种结构与C60相似的“分子足球N60”。N60在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法正确的是( )
A.N60是共价键构成的一种原子晶体 B.熔点:N60比N2高
C.稳定性:N60比N2高 D.等物质的量分解吸收的热量N60比N2高
10.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是 ( )
A.c(A-)≥c(M+) B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA水解,则c(OH-)>c(H+)
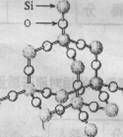
9.二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是 ()
A.1 mol SiO2 晶体中Si-O键为2mol B.晶体中Si、O原子个数比为1:2
C.晶体中Si、O原子最外电子层都满足8电子结构 D.晶体中最小环上的原子数为8
8.具有如下电子层结构的原子,其相应元素一定属于同一主族的是 ( )
 A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子
A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子
B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子
C.最外层电子排布为1s2的原子和最外层电子排 布为2s22p6的原子
D.最外层电子排布为1s2的原子和最外层电子排 布为2s2的原子
7.PH=12的NaOH溶液和PH=10的NaOH溶液混和后溶液的 ( )
A.PH=11 B.PH=10.3 C.C(H+)=2×10-12mol/L D.C(H+)=5×10-11mol/L
6.某密闭密闭容器中进行如下反应:X(g)+2Y(g)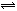 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
A.1<X/Y<3; B.1/4<X/Y<2/3 C.3< X/Y <4; D.1/4< X/Y <3/2
5.下列叙述正确的是 ( )
A.同周期元素的原子半径为ⅦA族的为最大B.在周期表中零族元素的单质从上到下熔沸点逐渐降低 C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
4.下列叙述正确的是 ( )
A .P4和NO2都是共价化合物 B .CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中,都不存在单个小分子
D.甲烷的分子是对称的平面结构,所以是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com