
题目列表(包括答案和解析)
4、在反应容器中充入1mol A气体和n mol B气体,在一定条件下发生反应
A(g)+ n B(g) mC(g):,达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的3/4,则n和m的数值可能是( )
mC(g):,达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的3/4,则n和m的数值可能是( )
A.n=1 m=1 B n=2 m=2
C n=3 m=3 D n=2 m=3
3、一定温度下,某容积不变的密闭容器中,反应达平衡状态,此时测得各物质的浓度分别是c(SO2)=2.0 mol/L c(O2)=0.8 mol/L c(SO3)=2.4 mol/L,则SO2起始浓度的取范围是( )
A、0-4.0mol/L B、0.4-4.0 mol/L
C、0.4-4.4 mol/L D、0-4.4mol/L
2、可逆反应:2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是()
2NO+O2在密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2: 2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A ①④⑥B ②③⑤C ①③④D ①②③④⑤⑥
1、对于反应4A+5B 4C+6D来说,以下化学反应速率的表示中,反应速率最快的是( )
4C+6D来说,以下化学反应速率的表示中,反应速率最快的是( )
A、V(A)=0.40mol/(L·S)
B、 B、V(B)=0.48mol/(L·S)
C、V(C)=0.36mol/(L·S)
D、D、V(D)=0.55mol/(L·S)
㈠、单项选择题
⒈下列操作不需要用玻璃棒的是( )
A. 过滤 B. 蒸发
C. 配制一定物质的量浓度溶液 D. 萃取
⒉现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 蒸馏、萃取、分液 B. 分液、蒸馏、萃取
C. 分液、萃取、蒸馏 D. 萃取、蒸馏、分液
⒊混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出在实际生产、生活中应用分离方法可行的是( )
a、分离豆浆和豆渣(过滤) b、海水制粗盐(蒸馏) c、除去水中的沙子(蒸发)
d、石油提炼汽油(蒸发) e、从稀溴水中提取溴(蒸馏)
A. 都不可行 B. 只有a可行 C. a、c可行 D. b、e可行
⒋已知丙酮是一种外观像水的无色液体,不溶于水,密度小于水,沸点低于水。要从水与丙酮的混合物中将丙酮分离出来,下列方法最合理的是( )
A. 蒸馏 B. 分液 C. 过滤 D. 蒸发
⒌下列实验中:①配制一定物质的量浓度的溶液;②pH试纸的使用;③过滤;④蒸发;⑤溶解。均用到的仪器是( )
A. 烧杯 B. 漏斗 C. 玻璃棒 D. 胶头滴管
⒍除去NaCl中含有的Ca2+、Mg2+、SO42―、HCO3―等离子,通常采用以下四种试剂:
①Na2CO3 ②BaCl2 ③NaOH ④HCl 。加入试剂合理的操作顺序是( )
A. ①②③④ B. ③①②④ C. ④②①③ D. ③②①④
⒎下列物质中,可用于萃取碘水中的碘的是( )
A. 四氯化碳 B. 水 C. 酒精 D. NaOH固体
㈡、填空题
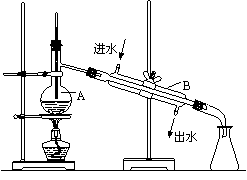 如图为实验室制取自来水的装置示意图,
如图为实验室制取自来水的装置示意图,
根据图示回答下列问题。
⑴图中的两处明显的错误是_____________
_____________________________________
_____________________________________。
⑵A仪器的名称是______________,B仪器
的名称是_______________。
⑶实验时A中除加入少量自来水外,
还需加入少量______________,其作用是___________________。
混合物的分离和提纯的方法
|
分离和提纯的方法 |
分离的物质 |
应注意的事项 |
应用举例 |
|
过滤 |
用于固液混合的分离 |
一贴、二低、三靠 |
如粗盐的提纯 |
|
蒸馏 |
提纯或分离沸点不同的液体混合物 |
防止液体暴沸,温度计水银球的位置,冷凝管中冷却水的流向 |
如石油的蒸馏 |
|
萃取 |
利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 |
选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂 |
用四氯化碳萃取溴水里的溴 |
|
分液 |
分离互不相溶的液体 |
打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出 |
如用四氯化碳萃取溴水里的溴后再分液 |
|
蒸发和结晶 |
用来分离和提纯几种可溶性固体的混合物 |
加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 |
分离NaCl和KNO3混合物 |
23.相同状况下的9 L甲烷与6 L某烯烃混合,所得混合气体的密度等于相同条件下的氧气的密度,试通过计算求该烯烃的分子式。
22.下列是有关实验室制乙炔的实验问题,请按要求回答:
(1)为了控制反应速率得到平稳的气流,采取的措施是 。
(2)用试管作反应容器时,在试管的上部需放置一团疏松的棉花,其作用是 。
(3)能否用启普发生器作反应器?为什么?
21.实验室常用酒精和浓硫酸共热制乙烯,试回答下列问题。
(1)酒精和浓硫酸的体积比为 ,混合时将 倒入 ,否则会 ,然后加入少量 ,以免混合液加热时 。
(2)该反应的化学方程式为 ,反应中浓硫酸的作用是 。
(3)气体发生装置中温度计应插在 。
(4)实验中要使温度迅速升高到170 ℃的原因是 。
(5)实验室通常用排水法而不用排气法收集乙烯,其原因是 。
(6)混合液逐渐变黑的原因是 。
20.实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合液,加入反应器中。
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50-60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤用无水CaCl2干燥后的硝基苯进行蒸馏,得到纯硝基苯。
填写:(1)配制一定比例的浓硫酸与浓硝酸混合酸时,操作注意事项是 。
(2)步骤③中,为了使反应在50-60 ℃下进行,常用的方法是 。
(3)步骤④中洗涤和分离硝基苯应使用的仪器是 。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是 。
(5)纯硝基苯是无色,密度比水 (填“大”或“小”),具有 气味的油状液体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com