
题目列表(包括答案和解析)
34.(8分)在500℃压强为1.01×105Pa 时,将2体积SO2和1体积O2的混合气体,通入一个装有催化剂的恒容密闭容器,结果能得到含91%(体积组成)SO3的混合气体,此时容器内反应物和生成物的浓度不再发生变化。
求:(1)此时混合物中SO2和O2的体积分数各为多少?
(2)计算SO2的转化率。
⑶求反应后容器的压强。
33.(5分)某工厂每天要烧掉含硫1.6%的烟煤100t,排出的SO2严重地污染环境。如果变废为宝,把这些SO2回收利用,那么,在理论上每年(以360天计算),可生产98%的浓硫酸多少吨?
32.(10分)如上图所示,实验室用NH4Cl和Ca(OH)2制取干燥的NH3 。试回答下列问题:
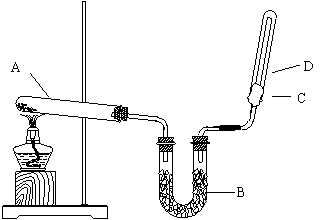
(1)画出NH3的电子式 。
(2)B处的药品是 。
(3)检验D处试管中NH3是否收集满,除用湿润的红色石蕊试纸外,还可采用什么简易方法。
(4)试举出实验室制取NH3的另外一种方法(不同反应类型和装置类型)
(5)在标准状况下,收集满一试管NH3后,将该试管放入水中,水上升充满试管,则试管中溶液的物质的量浓度为 。
31.(5分)某温度下,在1L密闭容器中反应N2+3H2 2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
(1)若X=0,Y=0,Z= 。
(2)若X=0.75,Y= ,Z= 。
(3)X、Y、Z应该满足的一般条件(用两个联立方程表示)
或 。
30. (8分) 将等物质的量的A、B、C、D四种物质混合,发生如下反应:
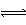 aA + bB c
C + d D(g)。
己知生成物C是固体,当反应进行一段时间后,测得A减小了n mol ,B减少了n/2 mol ,C增加了3n/2 mol ,D增加了 n mol ,此时反应达到平衡。(1)该反应的化学方程式中各物质的化学计量数是:
aA + bB c
C + d D(g)。
己知生成物C是固体,当反应进行一段时间后,测得A减小了n mol ,B减少了n/2 mol ,C增加了3n/2 mol ,D增加了 n mol ,此时反应达到平衡。(1)该反应的化学方程式中各物质的化学计量数是:
a = , c = 。
(2)如果只改变压强,反应速率发生变化,但平衡不发生移动,则反应中各物质的聚集状态是A , B 。
(3)如果只升高温度,反应一段时间后,测知这四种物质的量相等。则该正反应是
热反应。
29. (14分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随时间(min)的变化情况如下表:
(14分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随时间(min)的变化情况如下表:
|
实验序号 |
   温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
⑴在实验1,反应在10-20 min时间内以A的浓度变化表示的平均速率为
mol/(L﹒min)。
⑵在实验2中,A的初始浓度C2= mol/L,反应经20分钟达到平衡,可推测实验2中还隐含的条件是 。
⑶实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、<、=),且C3 1.0 mol/L(填>、<、=)。
⑷比较实验4和实验1,可推测该反应的正反应是 反应(选填吸热、放热)。理由是 。
28.(6分)在缺氧的条件下,砷化氢受热分解能形成亮黑色的“砷镜”,砷镜能被次氯酸溶液所溶解,其中生成物之一是砷酸,请写出这两个变化的化学方程式。
(1)
(2)
27. (14分)、将红热的黑色固体单质甲放入一黄色的溶液乙中,充分反应后,产生由两种气体组成的混合气体A,A在常温下不与空气作用,将A做如下的实验:
(14分)、将红热的黑色固体单质甲放入一黄色的溶液乙中,充分反应后,产生由两种气体组成的混合气体A,A在常温下不与空气作用,将A做如下的实验:
⑴ 推断各物质的化学式:甲:__________;乙:__________;丙:__________;
A:__________;B:__________; C:__________。
⑵写出甲与乙反应的化学方程式:_____________________________。
26.(5分)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
⑴□NaIO3+□NaHSO3 =□NaHSO4+□Na2SO4+□I2+□H2O
⑵已知含氧酸盐的氧化作用随溶液酸性的增强而增强。在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-生成的量,发现开始阶段反应速率呈现递增的趋势。试简述这变化趋势发生的原因: 。
25. 密闭容器中发生反应:X2 (g)+ Y2(g) = 2Z(g),已知X2、Y2、Z的起始量分别为0.1mol、0.3 mol、 0.2 mol,一定条件下达到平衡时,各组分的物质的量有可能是
A、Z为0.3 mol B、Y2为0.35 mol C、X2为0.2 mol D、Z为0.4 mol翰林汇
高二化学期中试卷

 选择题答题框:
选择题答题框:
第二卷 非选择题(共75分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com