
题目列表(包括答案和解析)
23.A、B两种物质都是由H、N、O、Na四种元素中的任意三种元素组成,它们的水溶液分别是酸性和碱性。在相同条件下,A溶液pH大于相同浓度的B溶液的pH(溶液的浓度不小于10-5 mol/L),请找出A与B可能有的两种组合,并且要求这两种组合中B溶液的pH相等时,第一种组合中的B溶液中水的电离度小于第二种组合中B溶液中水的电离度。
(1) 写出可能有的两种组合中A与B的化学式。
① A______B______;② A_______B________。
(2) pH相等时,第一种组合中的B溶液中水的电离度比第二种组合中B溶液中水的电离度小的原因是______________。
(3) 在上述第一种组合中,若A、B的物质的是浓度相同且温度相同,设A溶液中水的电离度为α1,B溶液中水的电离度为α2,那么α1和α2的关系是________。
22.我国规定饮用水的质量标准必须符合下列要求:
|
pH |
Ca2+,Mg2+浓度 |
细菌总数 |
|
6.5-8.5 |
<0.0045 mol/L |
<100个/mL |
以下是源水处理现成自来水的工艺流程示意图:
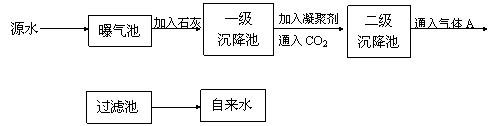
(1) 源水中含Ca2+,Mg2+, ,Cl-等,加入石灰后生成Ca(OH)2,进而发生复分解反应,写出其中一个离子反应方程式________。
,Cl-等,加入石灰后生成Ca(OH)2,进而发生复分解反应,写出其中一个离子反应方程式________。
(2) 凝聚剂除去悬浮固体颗粒的过程___________。
① 物理过程 ② 化学过程 ③ 物理化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成________沉淀。
(3) 通入CO2的目的是_______和________;气体A的作用是________,这种作用是基于气体A和水反应的产物具有________性。
(4) 下列物质中,可以作为气体A的代用品的是________
① Ca(ClO)2 ② NH3(液) ③ K2FeO4 ④ SO2
21.有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸,现只有石蕊试液,酚酞试液,pH试纸和蒸馏水,而没有其它试剂,简述如何用最简便的实验方法来判断哪瓶是强酸:___________。
20.有A,B,C,D,E五种盐溶液,它们的阳离子可能为K+, ,Ba2+,Al3+,
Ag+,Mg2+,Ca2+;它们的阴离子可能为Cl-,
,Ba2+,Al3+,
Ag+,Mg2+,Ca2+;它们的阴离子可能为Cl-,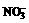 ,
,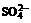 ,
,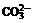 ,
,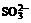 ,试根据下列实验现象判断五种盐的化学式。
,试根据下列实验现象判断五种盐的化学式。
(1) 五种盐均溶于水,形成无色溶液;
(2) A的溶液为中性,B的溶液为碱性,C,D,E的溶液为酸性;
(3) 在五种溶液中分别加入BaCl2溶液,A,E不产生沉淀;
(4) 若取B,C溶液混合,产生白色沉淀及无色、无味气体;
(5) 若取D溶液分别加入E,A溶液中,E产生白色沉淀,而A无反应;
(6) 在A、E溶液中分别加入Na2CO3溶液,则A产生白色沉淀,而E无反应。
则:A______,B______,C_______,D_______,E_______。
19.0.02 mol/L的HA溶液与0.02 mol/L的NaA溶液等体积混合,已知该混合液中
c(Na+)>c(A-),用“>,=,<”填空:
溶液中c(H+)______c(OH-);c(HA)______c(A-);
c(HA)+c(A-)_______0.02 mol/L。
18.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A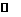 H++HA-
HA-
H++HA-
HA-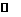 H++ A2-
H++ A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01 mol/L的H2A溶液
B.0.01 mol/L的NaHA溶液
C.0.02 mol/L的HCl与0.04 mol/L的NaHA溶液等体积混合
D.0.02 mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号)
(1) c(H+)最大的是_______,最小的是_________。
(2) c(H2A)最大的是_______,最小的是________。
(3) c(A2-)最大的是________,最小的是________。
17.在25℃时,有pH为x(x≤6)的盐酸和pH为y(y≥8)的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液。
(1) 若x+y=14时,则Vx/ Vy=___________;
(2) 若x+y=13时,则Vx/ Vy=___________;
(3) 若x+y>14时,则Vx/ Vy=___________(填表达式),并且Vx______ Vy (填>、=、<)。
16.已知4℃时,纯水中c(H+)=5×10-8 mol/L,此时的Kw=______;25℃时,Kw=________;25℃时,pH=4的盐酸中由H2O电离产生的c(H+)=_______。由上述数据可以得出:升温时水的电离度________,加酸或加碱时水的电离度_________(填增大或减小)。
15.将0.1 mol/L的NH4NO3与0.05 mol/L NaOH溶液等体积混合后,溶液中各种微粒的物质的量浓度大小关系正确的是( )
A.c(Na+)=c(NH3·H2O)=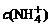 >c(OH-)
>c(OH-)
B.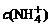 >c(Na+)>c(NH3·H2O)>c(OH-)
>c(Na+)>c(NH3·H2O)>c(OH-)
C.c(Na+)= >c(NH3·H2O)>c(OH-)
>c(NH3·H2O)>c(OH-)
D.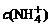 >c(Na+)>c(OH-)>c(NH3·H2O)
>c(Na+)>c(OH-)>c(NH3·H2O)
14.取pH均等于2的盐酸和醋酸各100 mL分别稀释2倍后,然后分别加入0.03 g的Zn粉,在相同条件下充分反应,有关叙述正确的是( )
A.醋酸与锌反应放出的H2多
B.盐酸和醋酸分别与锌反应放出的H2一样多
C.醋酸与锌反应速率大
D.盐酸和醋酸分别与锌反应的速率一样大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com