
题目列表(包括答案和解析)
4.有A、B两种物质,A和B化合生成C,C溶于水生成D,D和红热木炭反应又生成C,则A和B分别是( )
A.O2和SO2 B.N2和O2 C.NO和O2 D.H2和Cl2
3.鉴别二氧化氮和溴蒸气,下列哪一种方法最可靠( )
A.嗅气味 B.用湿润的淀粉碘化钾试纸
C.看颜色 D.用AgNO3溶液
2.下列比较正确的是( )
A.硝酸的酸性比磷酸强 B.PH3的稳定性大于NH3
C.PH3的还原性大于NH3 D.氮气的化学性质比磷活泼
1.受热时有红棕色气体放出,并留下黑色残渣的是( )
①Ca(NO3)2 ②NaNO3 ③Cu(NO3)2 ④NH4NO3
A.只有①和② B.只有③ C.只有③和④ D.只有②
24.在390 ℃,3.03×105 Pa下,以CO和H2为原料合成CH3OH,存在下列平衡:CO(气)+H2(气) ?CH3OH(气),当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的含量都有影响。
(1)以m表示H2和CO的物质的量之比,(即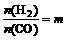 ),a表示CO的转化率,y为平衡时混合物中CH3OH的体积分数,试推断m,a,y三者的关系。
),a表示CO的转化率,y为平衡时混合物中CH3OH的体积分数,试推断m,a,y三者的关系。
(2)下表列出m=1,2,3,4时的一部分实验数据,试填出格中 a与y之值:
|
m |
1 |
2 |
3 |
4 |
|
a |
0.25 |
0.45 |
|
|
|
y |
|
|
19.35% |
16.35% |
(3)根据以上计算数据讨论:反应物比例对平衡混合物中CH3OH含量的影响,并选择一最佳比例。
23.“为了除去工业废气中的SO2,可将SO2转化为(NH4)2SO4。据有关资料介绍,摘录如下:
初步处理的废气中含0.2%SO2,10%的O2(都是体积分数),在400 ℃时,以5 m3/h的速度通过V2O5触媒层,然后以流量25 L/h的NH3混合,再喷入流量为2 908 g/h的水,此时气体温度迅速从400 ℃下降至200 ℃,在热的结晶装置中得到(NH4)2SO4晶体。”据此资料回答下列问题:
(1)按反应理论值,SO2和O2的物质的量之比为2∶1。经过初步处理的废气中SO2与O2的物质的量的比值为______,采用这种比值的原因是________________________。
(2)进行冷却后的原因是_______________________。
(3)若将SO2全部转化SO3,SO3全部转化为(NH4)2SO4,则资料中NH3 每小时通入量至少应是______L,由此可得出NH3的利用率为________。
22.在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通。容器中发生以下反应:N2+3H2?2NH3+Q,若达到平衡后,测得混合气体的体积为7体积。据此回答以下问题:
(1)保持上述反应的温度不变,假设a,b,c分别代表初始加入的N2,H2和NH3的体积,如果反应达到平衡时,各物质的百分含量与上述平衡完全相同,那么:
①若a=1,c=2,则b=_____,在此情况下,反应开始时将向______方向进行;
②若需规定起始时,反应向逆方向进行,则C的体积范围是________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是________。
21.下表数据是在某温度下,金属镁和镍分别在O2中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/n |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚y/nm |
0.05 a |
0.20 a |
0.45 a |
0.80 a |
1.25 a |
|
NiO层厚y’/nm |
b |
2 b |
3 b |
4 b |
5 b |
注:a和b均为与温度有关的常数。
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是_________。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填直线型,抛物线型,对数或双曲线等类型):MgO氧化膜厚y属______型,NiO氧化膜厚y’属______型。
(3)Mg和Ni比较,哪一种金属更具有耐腐蚀性______,其理由是______________。
20.对于可逆反应aA(气)+bB(气)?cC(气)+dD(气)达到平衡时,各物质的物质的量浓度满足以下关系: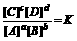 ,K为平衡常数。现有一反应:CO(气)+H2O(气)?CO2(气)+H2(气)+Q,在85 ℃时,K=1。
,K为平衡常数。现有一反应:CO(气)+H2O(气)?CO2(气)+H2(气)+Q,在85 ℃时,K=1。
(1)若升温至95 ℃时,达到平衡时K____1(填 <,>,=)。
(2)85 ℃时,固定容积的密闭容器中,放入混合物,起始浓度[CO]=0.01 mol/L,[H2O]=0.03 mol/L,[CO2]=0.01 mol/L,[H2]=0.05 mol/L,则反应开始时,H2O的消耗速率比生成速率_____(填大,小或不能确定)。
(3)保持温度,容器的体积不变,若往容器中充入适量的H2S气体,则重新达到平衡时,CO的反应速率比充H2S之前(填增大或减小)理由是_______________。
19.在10℃和2×105 Pa的条件下,反应aA(气)?d D(气)+eE(气)建立平衡,再逐步增加体系的压强(温度保持不变),下表表示不同压强下的反应建立平衡时物质D的浓度:
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/(mol/L) |
0.085 |
0.20 |
0.44 |
(1)压强从2×105增加到5×105 Pa时,平衡向_____方向移动,理由是_______。
(2)压强从2×105增加到1×106 Pa时,平衡向_____方向移动,理由是_______,平衡之所以向该方向移动,这是由于____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com