
题目列表(包括答案和解析)
24.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
① 2KNO3?2KNO2+O2↑
② 2Cu(NO3)3 ?2CuO+4NO2+O2↑
③ 2AgNO3 ?2Ag+2NO2+O2↑
今有固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的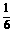 。通过计算(忽略氧在水中的溶解)回答:
。通过计算(忽略氧在水中的溶解)回答:
(1)该固体是否可能只是由一种盐组成的?若可能,指出是哪种盐。
(2)若固体是混合物,指出它的可能组成(物质的量之比)。
23.在一定条件下,NO跟NH3可发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4 g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
22.把某黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,将X作如下图所示实验:
 白色沉淀
白色沉淀
无色气体C
无色气体E
蓝色溶液G
无色溶液D
无色气体E
由此可判断:A的名称是_________,B的名称是________;C是_______、D是_________、R是________、E是________、G是________、X是________。
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:①反应前的X与反应后生成的Z的物质的量之比n(X) : n(Z)=2 : 3 ②单质Y的分子为正四面体构型。请填写下列空白:
(1)单质Y是__________,单质Z是__________(填写名称或分子式)。
(2)Y分子中共含_________个共价键。
(3)X分解为Y和Z的化学方程式为______________。
20.实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
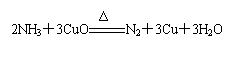 ,
,

试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(mCuO,mH2O)时,请用下列仪器设计一个简单的实验方案。
①仪器连接的顺序(用字母编号表示,仪器可重复使用)
D中浓硫酸的作用是_____________________。
实验完毕时观察到A中的现象是___________。
②列出计算Cu的相对原子质量的表达式____________。
③下列情况将使测定结果偏大的是_______________。
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有
A.mCu和mCuO
B.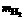 和
和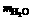
C.mCu和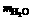 D.
D.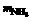 和
和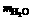
19.实验室中有一瓶已呈黄色的浓硝酸,这是由于其中含有_______。请设计简单方法除去杂质(不得降低硝酸的浓度)________,有关反应的化学方程式为_________。
18.在一定的温度和压强,4体积的某气态氢化物完全分解后,生成1体积的磷蒸气和6体积的氢气。此氢化物的化学式为_______,此反应的化学方程式为_______。
17.在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O.
(1)RO3n-中R元素的化合价是____________。
(2)R元素的原子最外层的电子数是
16.某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色变浅的原因是:______________
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是_____溶液;加热时溶液由无色变为红色的原因是_______________。
15.含有(NH4)2SO4、NH4NO3的混合溶液v L,加入a mol NaOH溶液后加热,恰好使NH3全部逸出;又加入b mol BaCl2刚好使SO42-完全沉淀,则原混合液中NH4NO3的物质的量浓度为( )
A.
ab mol/L B.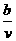 mol/L
C.
mol/L
C.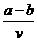 mol/L D.
mol/L D.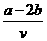 mol/L
mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com