
题目列表(包括答案和解析)
4.关于实验室制乙烯的实验,下列说法正确的是( )
A.反应物是乙醇和过量的3 mol/L硫酸的混合液。
B.温度计插入反应溶液的液面下,控制温度140℃
C.反应容器中应加入碎瓷片
D.反应完毕灭火后再从水中取出导管
解析:3 mol/L H2SO4为稀H2SO4;实验室制乙烯应控制温度为170℃;反应完毕应先从水中取导气管,再熄灭酒精灯。
答案:C
3.下列反应属于加成反应的是( )
A.C3H8+Cl2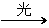 C3H7Cl+HCl
C3H7Cl+HCl
B.2FeCl2+Cl2====2FeCl3
C.CH2==CH2+H2O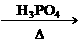 CH3CH2OH
CH3CH2OH
D.CH3CH2OH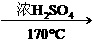 CH2==CH2↑+H2O
CH2==CH2↑+H2O
解析:由加成反应的定义可知,C项为加成反应。
答案:C
2.除去乙烷气中混有的乙烯,最好的方法是( )
A.加入氢气与乙烯反应 B.点燃
C.通入适量的溴水中 D.通过KMnO4溶液
解析:最好通过溴水,使乙烯与溴发生加成反应,且没有副产物生成。
答案:C
1.通常用于衡量一个国家石油化工发展水平的标志是( )
A.石油产量 B.乙烯产量
C.天然气产量 D.汽油产量
解析:乙烯是石油化学工业最重要的基础原料,它主要用于制造塑料、合成纤维、有机溶剂等。乙烯工业的发展,带动了其他以石油为原料的石油化工的发展。因此,一个国家乙烯工业的发展水平,已成为衡量该国家石油化学工业水平的重要标志之一。
答案:B
15.在标准状况下,有密度为0.478 g·L-1的乙烯、乙炔、氢气的混合气体,在加热条件下,通过镍催化剂,完全反应后再冷却到标准状况时,测得其密度为1.062 g·L-1。求原混合气体中各组分的体积分数。
解析:反应后混合气体的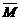 =1.062×22.4=23.8。因C2H2、C2H4、C2H6的相对分子质量都大于23.8,所以一定有H2,即H2过量。
=1.062×22.4=23.8。因C2H2、C2H4、C2H6的相对分子质量都大于23.8,所以一定有H2,即H2过量。
设原混合气体为100 L,由质量守恒可求得反应后气体体积为45 L,则反应H2为55 L。
由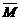 =23.8,根据十字交叉法可求得
=23.8,根据十字交叉法可求得
V(C2H6)∶V(H2)=3.52
则剩余H2为:45 L×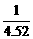 =10 L
=10 L
H2共有:55 L+10 L=65 L
C2H2、C2H4共有:100 L-65 L=35 L
则C2H2为:55 L-35 L=20 L
所以,原混合气体中,C2H4、C2H2、H2的体积分数分别为15%、20%、65%
答案: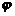 (C2H4)=15%,
(C2H4)=15%,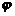 (C2H2)=20%,
(C2H2)=20%,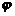 (H2)=65%
(H2)=65%
6.72 L气体物质的量为0.3 mol,质量为7.68 g,炔为4.8 g,甲烷为2.88 g。
n(CH4)=0.18 mol
n(炔)=0.12 mol
M(炔)=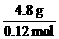 =40 g·mol-1
=40 g·mol-1
所以,B为C3H4
答案:A:CH4 B:C3H4
14.某烷烃A和炔烃B的混合气体物质的量为1 mol,质量为25.6 g。取6.72 L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加4.8 g,由此推断A为________,B为________。
解析: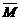 (混合气)=25.6 因M(C2H2)=26,所以,A一定是甲烷。
(混合气)=25.6 因M(C2H2)=26,所以,A一定是甲烷。
13.除去乙炔气体中混有的水蒸气,有时也可用电石作干燥剂,其原因是________。实验室保存电石的方法是________。
答案:电石易吸水并与水反应生成乙炔 密封
12.乙炔可使________和酸性________褪色,前者发生的是________(填反应类型)后者发生的是________反应。
答案:溴水 KMnO4溶液 加成 氧化
11.乙炔俗称________,纯净的乙炔是________,由电石生成的乙炔因常混有________而有特殊难闻的臭味。同温同压时乙炔的密度比空气的密度________(填“大”或“小”),但收集乙炔时一般不采用________法,这是因为________,常采用________,因为乙炔________水。乙炔含碳的质量分数比乙烯________,所以在空气中燃烧火焰________并伴有________同时放出________,在纯氧气中燃烧时温度可高达________,因此可用氧炔焰来________。
答案:电石气 无色无味的气体 PH3、H2S 小 排空气 乙炔的密度与空气的接近 排水法 微溶于 高 明亮 浓烟 大量的热 3000℃以上 焊接或切割金属
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com