
题目列表(包括答案和解析)
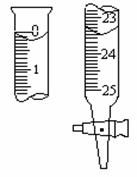
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);②使用时必须检查是否漏水的有 (填序号);
(2)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
③做中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定。(l)记录液面刻度读数。(m)根据滴定管的两次读数得出NaOH溶液体积为22 mL。指出上述实验错误之处(用编号表示) _____。

(4) 有一锥形瓶盛有用盐酸滴定过的氢氧化钠溶液(酚酞作指示剂),溶液已呈无色,如何确定是刚好滴到终点?还是盐酸过量? 请用简洁的文字说明:
20、(12分)为了证明一水合氨是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01 mol/L氨水、0.1 mol/L NH4Cl溶液、NH4Cl晶体、酚酞试剂、PH试纸、蒸馏水
(1)甲用PH试剂测出0.01 mol/L氨水的PH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?(填是或否) 并说明理由:
(2)乙取出10 mL 0.10 mol/L氨水,用PH试纸测出其PH = a,然后用蒸馏水稀释至1000 mL,再用PH试纸测出其PH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么关系? (用等式或不等式表示)
(3)丙取出10 mL 0.10mol/L氨水,滴入2 滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变(填深或浅) 。你认为这一方法能否证明一水合氨是弱电解质? (4)请你根据所提供的试剂,再提出一个合理又简便的方案证明一水合氨是弱电解质。
18、PH值均为2的盐酸和醋酸各100mL,分别稀释100倍,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A、醋酸与锌反应放出的氢气多 B、放出氢气酸醋酸与盐酸一样多
C、醋酸与锌反应速率快 D、盐酸和醋酸与锌反应的起始速率一样
第II卷(非选择题,共78分)
17、A+、B+、C-、D-四种离子两两组成可溶性盐,其中:AC盐与BD盐溶液PH=7,BC盐溶液PH>7,则下列说法不正确的是
A、 AD盐溶液PH>7 B、在AC盐溶液中:[A+]+[AOH]=[C-]+[HC]
C、将AD盐和BC盐等物质的量混合溶于水,溶液PH=7
D、酸电离程度一定是:HD>HC
16、常温下,pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合溶液的叙述正确的是
A、c(R2-)>c(Na+)>c(H+)=c(OH-) B、2c(R2-)+c(HR-)=c(Na+)
C、c(R2-)+c(OH-)=c(Na+)+c(H+) D、混合液的体积为2a L
15、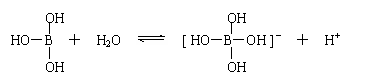 某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中只有一步电离过程,为:
某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中只有一步电离过程,为:
下列判断正确的是
A、该反应为水解反应 B、硼酸是三元酸 C、硼酸是两性氢氧化物
D、硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-=[B(OH)4]-
14、常温时,将下列溶液等体积混合后,所得混合液的pH小于7的是
A、pH为2的醋酸溶液与pH为12的氢氧化钠溶液
B、0.0l mol·L-1 的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液
C、pH为2的硫酸溶液与pH为12的氢氧化钠溶液
D、0.010 mol·L-1的盐酸溶液与0.010 mol·L-1的氢氧化钡溶液
13、下列离子方程式中书写正确的是
A、硫化钠溶于水中:S2-+2H2O 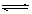 H2S↑+2OH-
H2S↑+2OH-
B. FeCl3水解:FeCl3 + 3 H2O = Fe(OH)3↓+ 3 H+
C. 碳酸氢钠溶液和氯化铝反应:3HCO3- + Al3+== Al(OH)3 ↓+3 CO2↑
D. 氨水中加入明矾溶液 3 OH- + Al3+ === Al(OH)3↓
12、Na2CO3溶液中,存在多种分子和离子,下列关系式中不正确的是
A、c [OH-] = c [HCO3-] + c [H+] + 2 c [H2CO3]
B、c [Na+] > c [CO32-] > c [OH-]> c [HCO3-] > c[H+]
C、c [Na+] = c [CO32-] + c [HCO3-] + c [H2CO3]
D、c [OH-] + c [HCO3-]+ 2 c [CO32-] = c [H+] + c[Na+]
11、物质的量浓度相同的三种盐 NaX、NaY 和 NaZ 的溶液,其中pH值依次为 8、9、10,则 HX、 HY、HZ 的酸性由强到弱的顺序是
A、HX、HZ、HY B、HZ、HY、HX
C、HX、HY、HZ D、HY、HZ、HX
10、25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)Fe(SO4)2的溶液中,测得C(NH4+) 分别为a、b、c(单位为mol/L)。下列判断正确的是
A、a = b = c B、a > b > c C、a > c > b D、c > a >b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com